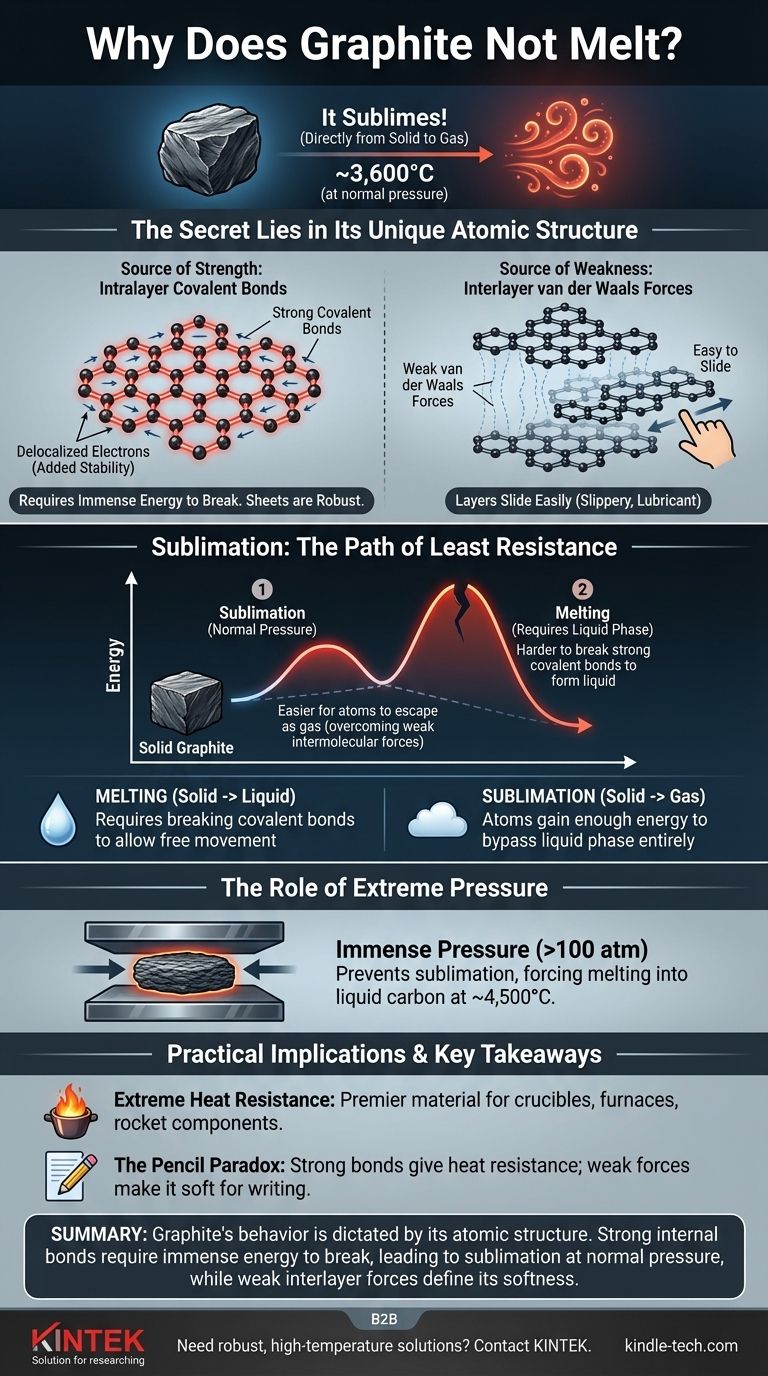
Распространено заблуждение, что графит не плавится. При нормальном атмосферном давлении графит ведет себя иначе: он сублимируется, переходя непосредственно из твердого состояния в газообразное при невероятно высокой температуре около 3600°C (6500°F). Такое поведение является прямым следствием огромной прочности химических связей, удерживающих его атомы углерода вместе.
Основная причина исключительной термостойкости графита заключается в его уникальной атомной структуре. Он состоит из слоев атомов углерода, соединенных исключительно прочными ковалентными связями, для разрыва которых и изменения состояния вещества требуется огромное количество энергии.

Деконструкция атомной структуры графита
Чтобы понять, почему графит ведет себя таким образом, необходимо рассмотреть, как расположены его атомы углерода. Его структура определяется двумя совершенно разными типами химических связей, действующих одновременно.
Источник прочности: ковалентные связи внутри слоев
Графит состоит из плоских двумерных листов атомов углерода, расположенных в гексагональной, похожей на пчелиные соты, решетке.
Внутри каждого листа каждый атом углерода связан с тремя другими прочными ковалентными связями. Это одни из самых сильных химических связей в природе.
Кроме того, один электрон от каждого атома углерода становится делокализованным, то есть он может свободно перемещаться по всему листу. Это совместное использование электронов всеми атомами в слое придает значительную стабильность и дополнительно укрепляет связи, делая листы невероятно прочными и трудными для разрушения.
Источник слабости: силы между слоями
В то время как атомы внутри слоя связаны мощно, сами слои удерживаются вместе гораздо более слабыми силами, известными как силы Ван-дер-Ваальса.
Эти силы достаточно слабы, чтобы слои легко скользили друг относительно друга. Вот почему графит кажется скользким и используется в качестве смазки и в карандашах — при письме на бумаге остаются слои графита.
Сублимация: путь наименьшего сопротивления
Чрезвычайная разница между прочными связями внутри слоев и слабыми силами между ними определяет, как графит реагирует на нагревание.
Плавление против сублимации
Плавление — это процесс перехода твердого вещества в жидкое. Для этого атомы должны получить достаточно энергии, чтобы освободиться от своих фиксированных положений, но при этом оставаться притянутыми друг к другу.
Сублимация — это прямой переход из твердого состояния в газообразное. В этом случае атомы получают так много энергии, что полностью минуют жидкую фазу и улетучиваются в воздух.
Почему сублимация преобладает при нормальном давлении
При стандартном атмосферном давлении энергия, необходимая для разрыва мощных ковалентных связей внутри слоев графита, огромна.
Прежде чем структура сможет поглотить достаточно энергии для плавления в жидкость, атомы на поверхности получают достаточно энергии, чтобы преодолеть слабые межмолекулярные силы и просто улететь в виде газа. Атомам энергетически проще перейти непосредственно в газообразное состояние, чем разорвать ковалентные связи, необходимые для образования жидкости.
Роль экстремального давления
Графит можно заставить плавиться, но только при чрезвычайных условиях.
Прикладывая огромное давление (более чем в 100 раз превышающее нормальное атмосферное давление), можно не дать атомам углерода улетучиться в виде газа. В этих условиях графит расплавится в жидкий углерод при температуре около 4500°C (8132°F).
Практические последствия этой структуры
Эта уникальная структура с двойным типом связей придает графиту набор свойств, которые кажутся противоречивыми, но имеют решающее значение для его промышленного применения.
Исключительная термостойкость
Высокая температура сублимации делает графит основным материалом для высокотемпературных сред. Он используется для изготовления тиглей для плавки металлов, футеровки печей и компонентов ракетных двигателей, которые должны выдерживать огромный жар.
Парадокс карандаша
Структура графита объясняет, как он может быть одновременно невероятно термостойким и на удивление мягким. Прочность исходит от ковалентных связей внутри слоев, в то время как мягкость и смазывающие свойства обусловлены легкостью, с которой эти слои скользят друг по другу.
Ключевые выводы для понимания графита
- Если ваш основной фокус — его поведение при нагревании: Помните, что при нормальном давлении графит сублимируется непосредственно в газ, потому что энергия, необходимая для этого, меньше, чем энергия, необходимая для разрыва ковалентных связей и образования жидкости.
- Если ваш основной фокус — его физические свойства: Ключевым моментом является его слоистая структура. Прочные связи внутри слоев обеспечивают термостойкость, в то время как слабые силы между слоями делают его мягким и эффективной смазкой.
- Если ваш основной фокус — техническое определение плавления: Графит абсолютно может плавиться, но только при чрезвычайно высоком давлении, которое не позволяет атомам сначала сублимироваться.
В конечном счете, поведение графита является прекрасной иллюстрацией того, как атомная структура материала определяет его реальные свойства.
Сводная таблица:
| Свойство | Описание | Ключевая причина |
|---|---|---|
| Температура сублимации | ~3600°C (при нормальном давлении) | Слабые силы Ван-дер-Ваальса между слоями позволяют атомам улетучиваться в виде газа до плавления. |
| Температура плавления | ~4500°C (при экстремальном давлении >100 атм) | Высокое давление предотвращает сублимацию, заставляя ковалентные связи разрываться для плавления. |
| Термостойкость | Отличная для высокотемпературных применений | Чрезвычайно прочные ковалентные связи внутри слоев углерода требуют огромной энергии для разрыва. |
Нужны надежные высокотемпературные решения для вашей лаборатории?
Уникальные свойства графита делают его незаменимым материалом для самых требовательных применений. В KINTEK мы специализируемся на поставке высококачественного лабораторного оборудования и расходных материалов, включая графитовые тигли и компоненты печей, разработанные для работы в экстремальных условиях.
Позвольте нашим экспертам помочь вам выбрать правильные материалы для повышения эффективности и безопасности вашей лаборатории. Свяжитесь с KINTEK сегодня, чтобы обсудить ваши конкретные высокотемпературные потребности!
Визуальное руководство
Связанные товары
- Вертикальная высокотемпературная вакуумная графитизационная печь
- Графитировочная печь сверхвысоких температур в вакууме
- Графитовая вакуумная печь для графитации пленки с высокой теплопроводностью
- Печь непрерывного графитирования в вакууме с графитом
- Лабораторная трубчатая печь высокой температуры 1400℃ с корундовой трубкой
Люди также спрашивают
- Какова термостойкость графита? Раскрытие его потенциала при высоких температурах в вашей лаборатории
- Каковы недостатки использования графита? Ключевые ограничения в высокотехнологичных приложениях
- Как производится синтетический графит? Глубокое погружение в высокотемпературный процесс
- Для чего используется графитовая печь? Достижение экстремально высоких температур до 3000°C в контролируемой среде
- Почему температура плавления графита высока? Раскрывая силу прочных ковалентных связей



















