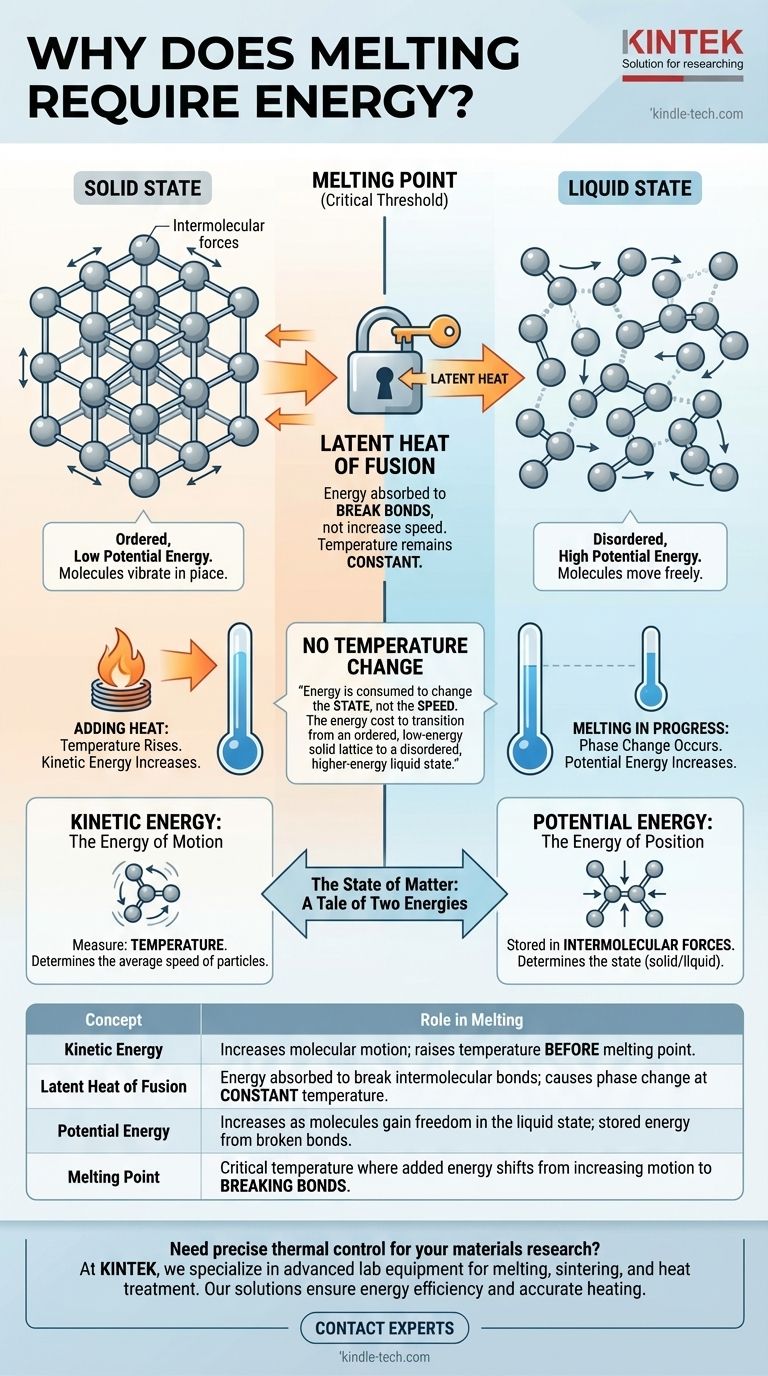
На молекулярном уровне плавление требует энергии, потому что эта энергия используется для разрушения жестких связей, удерживающих частицы вместе в фиксированной твердой структуре. Эта энергия, известная как скрытая теплота, не увеличивает скорость молекул — и, следовательно, не повышает температуру, — а вместо этого увеличивает их потенциальную энергию, давая им свободу двигаться и скользить друг мимо друга в виде жидкости.
Основная причина, по которой плавление требует энергии без изменения температуры, заключается в том, что энергия расходуется на изменение состояния, а не скорости молекул. Это энергетические затраты на переход от упорядоченного твердого кристаллического состояния с низкой энергией к неупорядоченному жидкому состоянию с более высокой энергией.

Состояние вещества: История двух энергий
Чтобы понять энергию плавления, мы должны сначала различать два типа энергии, которыми обладают молекулы: кинетическую и потенциальную.
Кинетическая энергия: Энергия движения
Кинетическая энергия — это энергия движения. В веществе она проявляется как вибрация, вращение и поступательное движение его составляющих атомов или молекул.
Температура вещества является прямой мерой средней кинетической энергии его частиц. Когда вы добавляете тепло, и вещество нагревается, это происходит потому, что его молекулы движутся быстрее.
Потенциальная энергия: Энергия положения
Потенциальная энергия в данном контексте — это энергия, запасенная в силах между молекулами, известных как межмолекулярные силы. Она определяется расположением и расстоянием между этими частицами.
Тесно связанная, упорядоченная структура, такая как твердое тело, имеет низкую потенциальную энергию. Неупорядоченная, свободно текущая структура, такая как жидкость, имеет более высокую потенциальную энергию, потому что молекулы находятся дальше друг от друга и менее ограничены.
Твердое состояние: Высокоупорядоченная структура
В твердом теле частицы заблокированы в фиксированном, повторяющемся узоре, называемом кристаллической решеткой. Они удерживаются на месте сильными межмолекулярными силами.
Хотя они не являются неподвижными, их кинетическая энергия ограничена вибрацией на месте. У них не хватает энергии, чтобы преодолеть силы, удерживающие их в этой жесткой структуре.
Разгадка процесса плавления
Фазовый переход из твердого состояния в жидкое происходит в отдельном, поэтапном процессе, в котором энергия выделяется для выполнения очень специфической задачи.
Добавление тепла: Первая стадия
Когда вы начинаете добавлять тепло к твердому телу (например, ко льду ниже его точки плавления), энергия поглощается как кинетическая энергия. Частицы вибрируют все более интенсивно внутри решетки.
На этой стадии температура твердого тела неуклонно растет.
Достижение точки плавления: Критический порог
Точка плавления — это температура, при которой частицы вибрируют настолько сильно, что готовы вырваться из решетки.
При этой точной температуре происходит фундаментальный сдвиг. Любая дополнительная добавленная энергия больше не увеличивает скорость вибрации (кинетическую энергию). Вместо этого она направляется исключительно на преодоление межмолекулярных сил.
Роль скрытой теплоты плавления
Энергия, необходимая для изменения вещества из твердого состояния в жидкое при его точке плавления, называется скрытой теплотой плавления. Слово «скрытая» означает невидимая, потому что это подведение энергии не приводит к изменению температуры.
Представьте, что вы используете ключ, чтобы открыть клетку. Энергия не заставляет обитателя бегать быстрее внутри клетки; она используется исключительно для того, чтобы открыть замок и позволить ему выбраться.
От порядка к беспорядку: Жидкое состояние
Когда молекулы поглощают достаточно скрытой теплоты, они вырываются из своих фиксированных положений в решетке. Жесткая структура разрушается, и вещество становится жидкостью.
В этом новом жидком состоянии частицы имеют гораздо более высокую потенциальную энергию, но их средняя кинетическая энергия (температура) такая же, как у твердого тела, из которого оно только что расплавилось. Только после того, как все твердое тело расплавится, дальнейшее добавление тепла начнет увеличивать кинетическую энергию и, следовательно, температуру жидкости.
Понимание ключевого различия: Тепло против температуры
Понятие скрытой теплоты разрешает распространенное заблуждение. Оно подчеркивает разницу между добавлением энергии и наблюдением повышения температуры.
Распространенное заблуждение
Многие задаются вопросом: «Если я продолжаю добавлять тепло тающему льду, почему температура остается на уровне 0°C (32°F)?»
Ответ заключается в том, что во время фазового перехода у энергии есть другая задача. Ее приоритет — разрушать связи, а не увеличивать скорость.
Тепло — это передача энергии, Температура — это измерение
Тепло — это передача тепловой энергии. Температура — это измерение средней кинетической энергии.
Во время плавления вы непрерывно передаете тепло в систему, но эта энергия преобразуется в потенциальную энергию, оставляя среднюю кинетическую энергию — и, следовательно, температуру — неизменной.
Как применить этот принцип
Понимание этой концепции имеет основополагающее значение для многих практических применений и научных областей.
- Если ваше основное внимание уделяется повседневным наблюдениям (например, кубику льда в напитке): Энергия, поглощаемая из более теплой жидкости, используется в качестве скрытой теплоты для разрушения молекулярных связей льда, поэтому напиток остывает, а сам лед плавится при постоянной температуре.
- Если ваше основное внимание уделяется инженерии или материаловедению: Удельная скрытая теплота плавления является критическим свойством, определяющим энергетические затраты на плавление металлов или других материалов, что напрямую влияет на конструкцию печей, энергопотребление и эффективность процессов.
- Если ваше основное внимание уделяется химии или физике: Помните, что фазовые переходы представляют собой сдвиг потенциальной энергии (из-за изменений в межмолекулярных силах), в то время как изменения температуры представляют собой сдвиг кинетической энергии (из-за изменений в молекулярном движении).
Понимание роли скрытой теплоты является ключом к пониманию того, как энергия вызывает изменения в физическом состоянии всей материи.
Сводная таблица:
| Концепция | Роль при плавлении |
|---|---|
| Кинетическая энергия | Увеличивает молекулярное движение; повышает температуру до точки плавления. |
| Скрытая теплота плавления | Энергия, поглощаемая для разрушения межмолекулярных связей; вызывает фазовый переход при постоянной температуре. |
| Потенциальная энергия | Увеличивается по мере того, как молекулы обретают свободу в жидком состоянии; запасенная энергия от разрушенных связей. |
| Точка плавления | Критическая температура, при которой добавленная энергия переключается с увеличения движения на разрушение связей. |
Нужен точный контроль температуры для ваших материаловедческих исследований? В KINTEK мы специализируемся на передовом лабораторном оборудовании, которое обеспечивает точный нагрев и управление температурой для таких процессов, как плавление, спекание и термообработка. Работаете ли вы с металлами, керамикой или другими материалами, наши решения гарантируют энергоэффективность и воспроизводимость результатов. Свяжитесь с нашими экспертами сегодня, чтобы найти идеальную печь или систему нагрева для вашей лаборатории.
Визуальное руководство
Связанные товары
- Лабораторная муфельная печь с нижним подъемом
- Муфельная печь 1800℃ для лаборатории
- Муфельная печь 1400℃ для лаборатории
- Муфельная печь 1700℃ для лаборатории
- Лабораторная трубчатая печь высокой температуры 1400℃ с корундовой трубкой
Люди также спрашивают
- Что такое система контроля температуры для цифровых приложений? Ключ к надежной работе электроники
- Какова роль лабораторной конвективной сушилки в производстве ингибиторов коррозии в твердом состоянии? - KINTEK
- Как измерить содержание золы? Выберите правильный метод для получения точных результатов
- Что такое спекание, с примером? Руководство по спеканию порошков в твердые детали
- Какова цель полного отжига? Достижение максимальной мягкости и пластичности стали
- Какую роль играет печь для сушки с принудительной циркуляцией воздуха при сушке MWCNTs/TiO2? Обеспечение целостности структуры нанокомпозита
- Что такое мишень для золотого напыления? Источник высокой чистоты для прецизионных золотых покрытий
- Каков первый шаг преобразования биомассы в энергию? Выберите правильный путь для вашего сырья



















