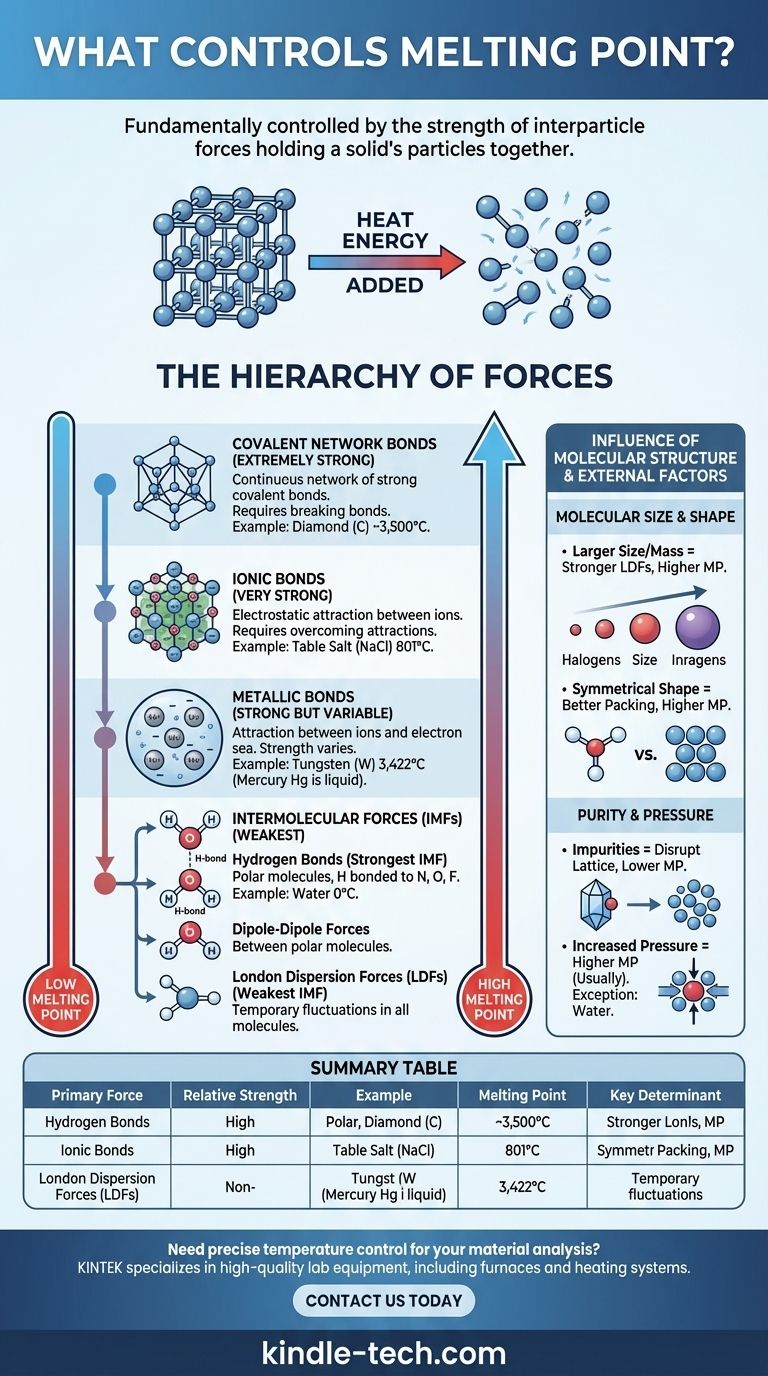
Температура плавления вещества фундаментально определяется силой связей, удерживающих его частицы вместе. В твердом теле частицы (атомы, ионы или молекулы) зафиксированы в упорядоченном расположении, называемом кристаллической решеткой. Чтобы расплавить твердое тело, необходимо добавить достаточно тепловой энергии, чтобы эти частицы смогли преодолеть эти силы и двигаться относительно друг друга как жидкость. Следовательно, более сильные связи требуют больше энергии для разрыва, что приводит к более высокой температуре плавления.
Основной принцип прост: плавление — это не разрушение самих частиц, а преодоление сил притяжения между ними. Тип и сила этих межчастичных сил — от мощных ионных связей до слабых межмолекулярных притяжений — являются основными определяющими факторами температуры плавления вещества.

Иерархия сил
Огромное разнообразие температур плавления — от -259°C у водорода до 3422°C у вольфрама — можно понять, классифицируя силы, удерживающие твердое тело вместе. Эти силы существуют в четкой иерархии по силе.
Ионные связи (очень сильные)
В ионных соединениях, таких как поваренная соль (NaCl), частицы представляют собой положительно и отрицательно заряженные ионы. Они удерживаются вместе мощными электростатическими притяжениями в жесткой кристаллической решетке.
Преодоление этих сильных ионных связей требует огромного количества тепловой энергии. Следовательно, ионные соединения постоянно демонстрируют очень высокие температуры плавления.
Ковалентные сетевые связи (чрезвычайно сильные)
В ковалентных сетевых твердых телах атомы соединены обширной, непрерывной сетью прочных ковалентных связей. Отдельных молекул нет; весь кристалл по существу является одной гигантской молекулой.
Такие вещества, как алмаз (углерод) и кварц (диоксид кремния), являются яркими примерами. Чтобы расплавить их, необходимо разорвать эти чрезвычайно прочные ковалентные связи, что требует огромного количества энергии, приводя к исключительно высоким температурам плавления.
Металлические связи (сильные, но изменчивые)
Металлы состоят из решетки положительных ионов металла, находящихся в «море» делокализованных электронов, которые свободно перемещаются по всей структуре. Притяжение между положительными ионами и этим электронным морем составляет металлическую связь.
Сила этой связи, а следовательно, и температура плавления, сильно варьируется. Она зависит от таких факторов, как заряд иона и количество делокализованных электронов. Вот почему ртуть является жидкостью при комнатной температуре, в то время как вольфрам имеет одну из самых высоких температур плавления среди всех элементов.
Межмолекулярные силы (самые слабые)
Для молекулярных соединений (таких как вода, сахар или воск) силами, которые необходимо преодолеть для плавления, являются межмолекулярные силы (ММС) — притяжения между отдельными молекулами. Они значительно слабее, чем ионные, ковалентные или металлические связи, обсуждавшиеся выше.
Существует три основных типа ММС:
- Водородные связи: Самый сильный тип ММС. Он возникает в полярных молекулах, где водород непосредственно связан с сильно электроотрицательным атомом (азотом, кислородом или фтором). Относительно высокая температура плавления воды (0°C) обусловлена этими сильными водородными связями.
- Диполь-дипольные силы: Возникают между полярными молекулами, имеющими постоянные положительные и отрицательные концы. Эти силы слабее водородных связей.
- Лондоновские дисперсионные силы (ЛДФ): Самые слабые ММС, присутствующие во всех молекулах. Они возникают из-за временных, случайных флуктуаций в распределении электронов. Хотя по отдельности они слабы, их кумулятивный эффект может быть значительным в более крупных молекулах.
Влияние молекулярной структуры
Помимо типа силы, специфический размер и форма частиц играют решающую роль, особенно для молекулярных соединений.
Молекулярный размер и масса
Для соединений с одной и той же основной межмолекулярной силой (например, ЛДФ) более крупные молекулы имеют более высокие температуры плавления. Это связано с тем, что более крупные молекулы имеют больше электронов, создавая более «поляризуемое» электронное облако, что приводит к более сильным лондоновским дисперсионным силам.
Эта тенденция четко прослеживается у галогенов: температура плавления увеличивается при переходе от фтора (F₂) к йоду (I₂).
Молекулярная форма и эффективность упаковки
Способность молекулы плотно и эффективно упаковываться в кристаллическую решетку оказывает большое влияние. Симметричные молекулы часто имеют более высокие температуры плавления, чем менее симметричные изомеры, даже если они имеют одинаковую формулу и массу.
Симметричные формы позволяют молекулам плотнее прилегать друг к другу в твердом состоянии, максимизируя эффективность их межмолекулярных сил. Разрушение этой хорошо организованной структуры требует больше энергии.
Понимание компромиссов и нюансов
Прогнозирование температур плавления включает взвешивание этих взаимосвязанных факторов.
Чистота меняет все
Принципы, изложенные выше, предполагают чистое вещество. Примеси нарушают упорядоченную кристаллическую решетку, ослабляя общую структуру.
Это нарушение облегчает плавление твердого тела. В результате нечистое вещество будет плавиться при более низкой температуре и в более широком диапазоне, чем его чистое. Это явление известно как депрессия температуры плавления.
Давление играет роль
Температуры плавления обычно указываются при стандартном атмосферном давлении. Для большинства веществ повышение давления увеличивает температуру плавления, потому что оно физически сближает частицы, укрепляя структуру решетки.
Вода является известным и важным исключением. Поскольку твердый лед менее плотен, чем жидкая вода, повышенное давление способствует более плотной жидкой фазе, тем самым понижая температуру плавления.
Как применить это к вашему анализу
При сравнении веществ используйте систематический подход для выявления ключевых факторов.
- Если ваша основная цель — сравнение различных классов твердых тел: Сначала определите основную связующую силу — ионную, ковалентную сетевую, металлическую или межмолекулярную. Это даст вам наиболее значимый показатель относительной температуры плавления.
- Если ваша основная цель — сравнение двух молекулярных соединений: Определите самую сильную межмолекулярную силу, которой обладает каждое из них (водородные связи > диполь-дипольные > ЛДФ). Соединение с более сильной ММС, как правило, будет иметь более высокую температуру плавления.
- Если ваша основная цель — сравнение похожих неполярных молекул: Молекула с большей массой и площадью поверхности будет иметь более сильные лондоновские дисперсионные силы и, следовательно, более высокую температуру плавления.
- Если ваша основная цель — сравнение изомеров (одинаковая формула, разная форма): Более симметричная молекула, которая может более эффективно упаковываться в кристаллическую решетку, часто будет иметь более высокую температуру плавления.
Понимая эту иерархию сил и влияние структуры, вы можете систематически объяснять поведение плавления практически любого вещества.
Сводная таблица:
| Основной тип силы | Относительная сила | Пример вещества | Температура плавления | Ключевой определяющий фактор |
|---|---|---|---|---|
| Ковалентная сетевая | Чрезвычайно сильная | Алмаз (C) | ~3500°C | Разрыв ковалентных связей в непрерывной решетке |
| Ионные связи | Очень сильные | Хлорид натрия (NaCl) | 801°C | Преодоление электростатических притяжений между ионами |
| Металлические связи | Сильные (переменные) | Вольфрам (W) | 3422°C | Сила притяжения ионов и электронного моря |
| Межмолекулярные силы | Самые слабые | Вода (H₂O) | 0°C | Водородные связи, диполь-дипольные силы, лондоновские дисперсионные силы |
Нужен точный контроль температуры для анализа ваших материалов? Понимание температур плавления критически важно для получения надежных лабораторных результатов. В KINTEK мы специализируемся на высококачественном лабораторном оборудовании, включая печи и системы нагрева, разработанные для точного термического анализа. Независимо от того, работаете ли вы с высокоплавкими металлами или чувствительными молекулярными соединениями, наши решения обеспечивают стабильную производительность. Свяжитесь с нами сегодня, чтобы обсудить, как наши продукты могут улучшить возможности вашей лаборатории и поддержать ваши исследования. Свяжитесь с нами через форму обратной связи, чтобы начать!
Визуальное руководство
Связанные товары
- Лабораторная муфельная печь с нижним подъемом
- Муфельная печь 1800℃ для лаборатории
- Муфельная печь 1400℃ для лаборатории
- Муфельная печь 1700℃ для лаборатории
- Лабораторная трубчатая печь высокой температуры 1400℃ с корундовой трубкой
Люди также спрашивают
- Почему удаление связующего вещества имеет решающее значение? Критический этап для получения прочных и плотных металлических и керамических деталей
- Какова механическая функция верхнеприводной цифровой мешалки? Оптимизация эффективности растворения диска молибдена
- Как молибден повышает коррозионную стойкость? Укрепление долговечности сплавов против точечной коррозии и воздействия хлоридов
- Каковы ограничения процесса SLS? Понимание ключевых компромиссов для функциональных деталей
- Каково применение пиролизного топлива? Устойчивый заменитель для промышленного отопления и энергетики
- Как получить изолят ТГК из дистиллята? Освойте передовой лабораторный процесс очистки
- Почему точный контроль температуры и давления необходим для корпусов гильз, подверженных горению? Обеспечение структурной целостности
- Каковы преимущества фильтров-центрифуг? Обеспечьте быструю и бережную подготовку проб для вашей лаборатории



















