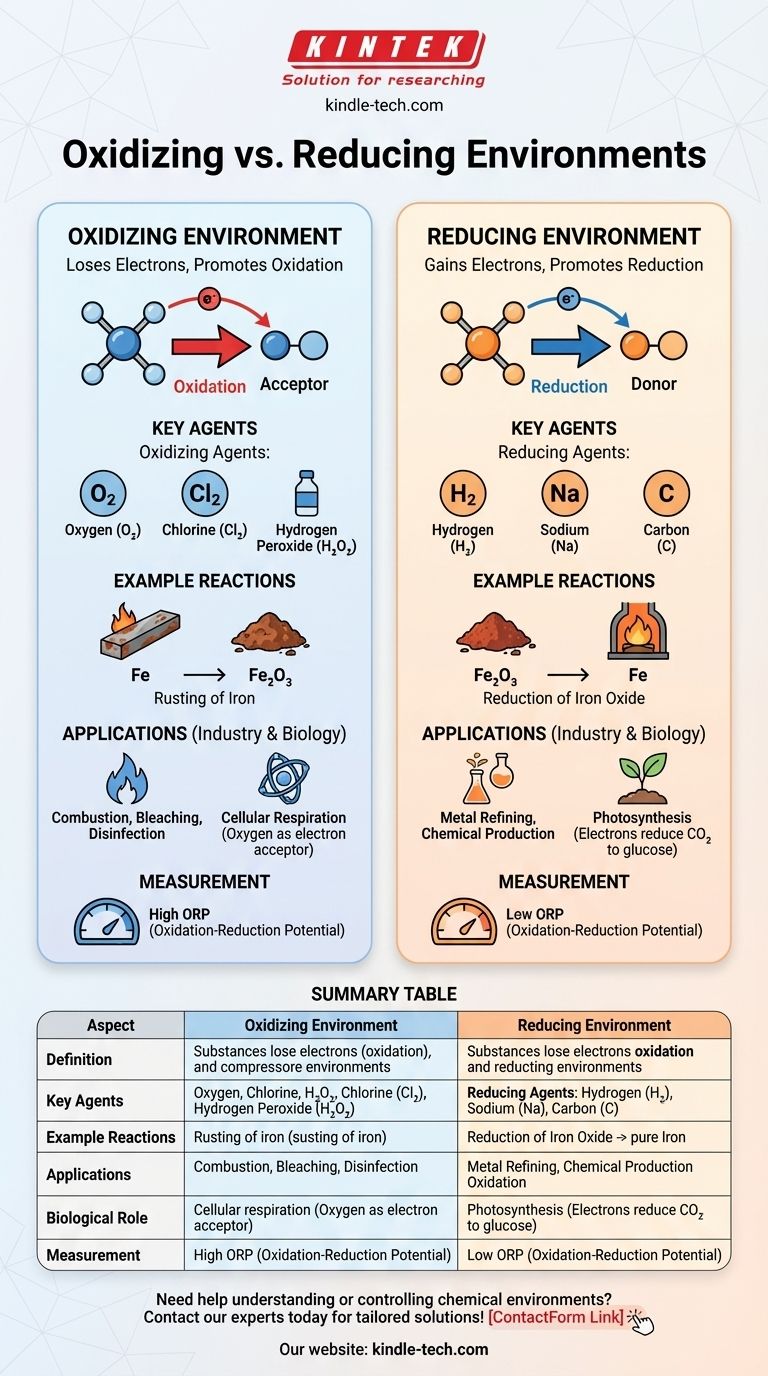
В химии окислительная среда — это среда, в которой вещества склонны терять электроны, способствуя окислительным реакциям, в то время как восстановительная среда — это среда, в которой вещества склонны принимать электроны, способствуя восстановительным реакциям. Ключевое различие заключается в доступности акцепторов электронов (окислителей) или доноров электронов (восстановителей). Окислительные среды характеризуются присутствием окислителей, таких как кислород или галогены, которые способствуют потере электронов. В отличие от них, восстановительные среды содержат восстановители, такие как водород или металлы, которые способствуют приему электронов. Эти среды играют решающую роль в химических реакциях, промышленных процессах и биологических системах.

Ключевые моменты объяснены:
-
Определение окислительной и восстановительной сред:
- Окислительная среда: Химическая среда, в которой вещества с большей вероятностью теряют электроны, что приводит к окислению. Эта среда богата окислителями, такими как кислород, хлор или другие акцепторы электронов.
- Восстановительная среда: Химическая среда, в которой вещества с большей вероятностью принимают электроны, что приводит к восстановлению. Эта среда богата восстановителями, такими как водород, металлы или другие доноры электронов.
-
Роль окислителей и восстановителей:
- Окислители: Это вещества, которые принимают электроны от других веществ, тем самым окисляя их. Типичные примеры включают кислород (O₂), хлор (Cl₂) и пероксид водорода (H₂O₂).
- Восстановители: Это вещества, которые отдают электроны другим веществам, тем самым восстанавливая их. Типичные примеры включают водород (H₂), натрий (Na) и углерод (C).
-
Химические реакции в различных средах:
- Окислительная среда: В такой среде преобладают реакции окисления. Например, ржавление железа происходит в окислительной среде, где железо (Fe) теряет электроны, переходя к кислороду, образуя оксид железа (Fe₂O₃).
- Восстановительная среда: В такой среде преобладают реакции восстановления. Например, восстановление оксидов металлов до чистых металлов происходит в восстановительной среде, например, когда углерод используется для восстановления оксида железа до железа в доменной печи.
-
Применение в промышленности и биологии:
- Промышленное применение: Окислительные среды используются в таких процессах, как горение, отбеливание и дезинфекция. Восстановительные среды имеют решающее значение в таких процессах, как переработка металлов и производство некоторых химикатов.
- Биологические системы: В биологических системах окислительные среды встречаются в таких процессах, как клеточное дыхание, где кислород выступает в качестве конечного акцептора электронов. Восстановительные среды встречаются в таких процессах, как фотосинтез, где электроны используются для восстановления углекислого газа до глюкозы.
-
Измерение и контроль:
- Окислительно-восстановительный потенциал (ОВП): ОВП — это мера склонности химической среды либо принимать, либо терять электроны. Высокий ОВП указывает на окислительную среду, в то время как низкий ОВП указывает на восстановительную среду.
- Контроль в промышленных процессах: В промышленности контроль окислительного или восстановительного характера среды имеет решающее значение для оптимизации химических реакций, обеспечения качества продукции и предотвращения нежелательных побочных реакций.
-
Примеры окислительной и восстановительной сред:
- Окислительная среда: Атмосфера Земли является окислительной средой из-за присутствия кислорода. Вот почему металлы, такие как железо, корродируют при контакте с воздухом.
- Восстановительная среда: Внутренняя часть доменной печи является восстановительной средой, где угарный газ (CO) действует как восстановитель для превращения железной руды (Fe₂O₃) в металлический чугун (Fe).
Понимая различия между окислительной и восстановительной средами, химики и инженеры могут лучше контролировать и оптимизировать химические реакции в различных приложениях, от промышленных процессов до биологических систем.
Сводная таблица:
| Аспект | Окислительная среда | Восстановительная среда |
|---|---|---|
| Определение | Вещества теряют электроны (окисление) из-за акцепторов электронов, таких как кислород или галогены. | Вещества принимают электроны (восстановление) из-за доноров электронов, таких как водород или металлы. |
| Ключевые агенты | Окислители: Кислород (O₂), хлор (Cl₂), пероксид водорода (H₂O₂). | Восстановители: Водород (H₂), натрий (Na), углерод (C). |
| Примеры реакций | Ржавление железа (Fe → Fe₂O₃). | Восстановление оксида железа до железа (Fe₂O₃ → Fe). |
| Применение | Горение, отбеливание, дезинфекция. | Переработка металлов, химическое производство. |
| Биологическая роль | Клеточное дыхание (кислород в качестве акцептора электронов). | Фотосинтез (электроны восстанавливают CO₂ до глюкозы). |
| Измерение | Высокий окислительно-восстановительный потенциал (ОВП). | Низкий окислительно-восстановительный потенциал (ОВП). |
Нужна помощь в понимании или контроле химических сред? Свяжитесь с нашими экспертами сегодня для получения индивидуальных решений!
Визуальное руководство
Связанные товары
- Печь с контролируемой атмосферой азота и водорода
- Оборудование системы HFCVD для нанесения наноалмазного покрытия на волочильные фильеры
- Печь для трубчатого химического осаждения из паровой фазы, изготовленная на заказ, универсальная система оборудования для химического осаждения из паровой фазы
- Печь для вакуумной индукционной плавки лабораторного масштаба
- Графитировочная печь для вакуумного графитирования материалов отрицательного электрода
Люди также спрашивают
- Для чего используются водородные печи? Достижение чистоты и скорости в высокотемпературной обработке
- Почему для композита W-Cu необходима печь с водородной атмосферой? Обеспечение превосходной инфильтрации и плотности
- Каковы основные преимущества использования водородного обжига для спекания деталей? Достижение максимальной плотности и коррозионной стойкости
- Что такое водородный отжиг? Достигните превосходных свойств материала с помощью светлого отжига
- Почему для отжига вольфрама необходимо поддерживать восстановительную атмосферу водорода? Обеспечение чистоты при высокотемпературной обработке












