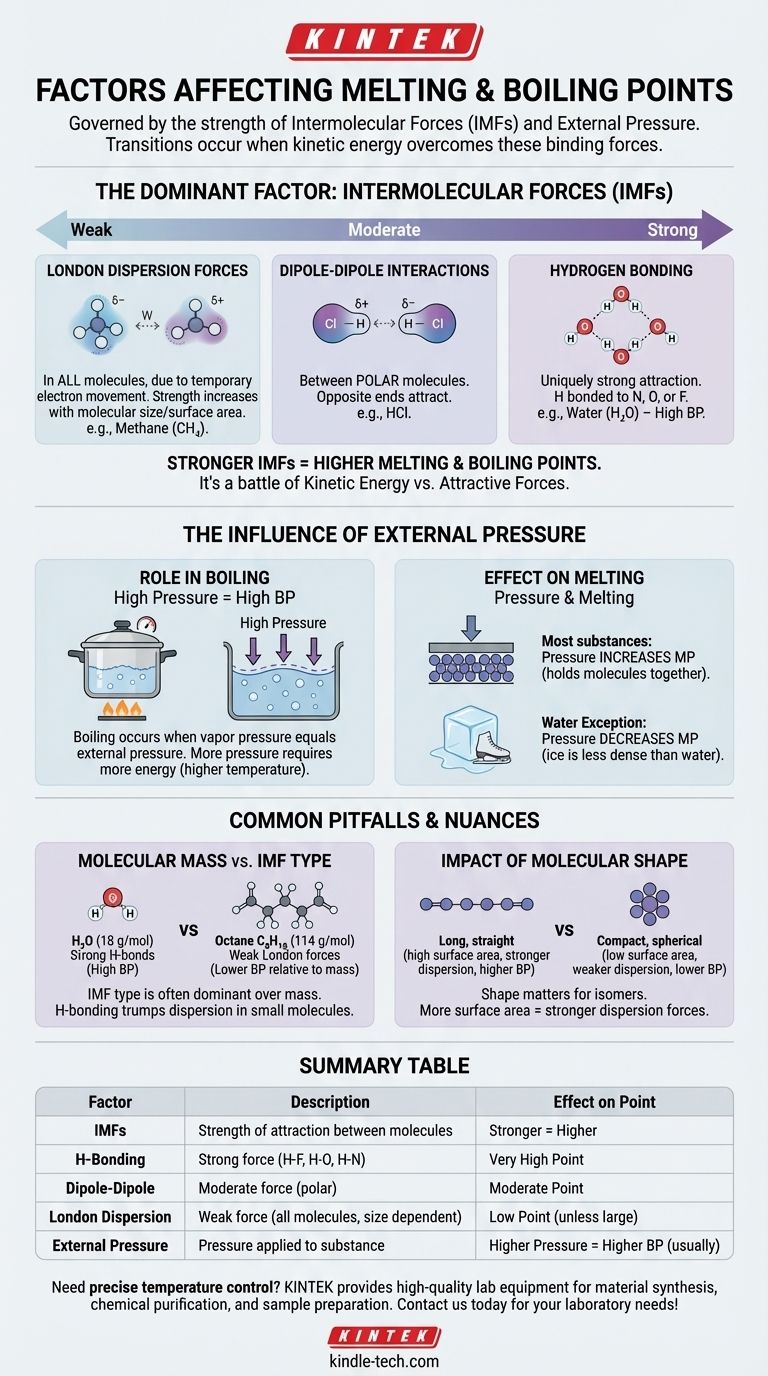
В самом фундаментальном смысле, на температуру плавления и кипения вещества влияют два основных фактора: сила межмолекулярных сил (ММС), удерживающих его молекулы вместе, и приложенное к нему внешнее давление. По сути, эти переходы происходят, когда молекулы получают достаточно энергии, чтобы преодолеть силы, связывающие их, и давление, сдерживающее их.
Основной вывод заключается в том, что плавление и кипение зависят не только от температуры; это физическая борьба между кинетической энергией молекулы и силами притяжения, которые удерживают ее рядом с соседями. Чем сильнее эти притяжения, тем больше энергии требуется для их разрушения.

Доминирующий фактор: Межмолекулярные силы (ММС)
Единственным наиболее важным фактором, определяющим температуру плавления и кипения вещества, является сила притяжения между его отдельными молекулами. Это не прочные ковалентные связи внутри молекулы, а более слабые силы, которые заставляют молекулы прилипать друг к другу.
Что такое межмолекулярные силы?
Представьте ММС как молекулярный эквивалент магнитов. Некоторые молекулы похожи на мощные электромагниты, в то время как другие — на слабые холодильные магниты. Преодоление этой «липкости» требует энергии в виде тепла.
Иерархия сил
Межмолекулярные силы различаются по силе, образуя четкую иерархию. Понимание этой иерархии является ключом к прогнозированию того, какие вещества будут иметь более высокую или более низкую температуру кипения.
Водородная связь (самая сильная) Это уникально сильный тип притяжения, который возникает, когда водород связан с высокоэлектроотрицательным атомом, таким как азот (N), кислород (O) или фтор (F). Вода (H₂O) является классическим примером, и ее мощные водородные связи объясняют, почему она имеет такую удивительно высокую температуру кипения для своего небольшого размера.
Диполь-дипольные взаимодействия (умеренные) Эти силы существуют между полярными молекулами — молекулами, которые имеют постоянный частичный положительный заряд на одном конце и частичный отрицательный заряд на другом. Эти противоположные концы притягиваются друг к другу, удерживая вещество вместе умеренно хорошо.
Лондоновские дисперсионные силы (самые слабые) Эти силы существуют во всех молекулах, вызванные временным, случайным движением электронов, которое создает мимолетные диполи. Хотя они индивидуально слабы, они становятся более значительными по мере увеличения размера и площади поверхности молекулы. Вот почему более крупные молекулы, такие как октан (C₈H₁₈), являются жидкостями при комнатной температуре, в то время как меньшие, такие как метан (CH₄), являются газами.
Влияние внешнего давления
Внешнее давление действует как физическая крышка на вещество, затрудняя молекулам переход в следующую фазу (из твердого в жидкое или из жидкого в газообразное).
Роль давления в кипении
Кипение происходит, когда внутреннее давление пара жидкости равно внешнему атмосферному давлению.
Если вы увеличиваете внешнее давление (например, используя скороварку), вы повышаете температуру кипения, потому что молекулам требуется больше энергии, чтобы противостоять этой более сильной внешней силе.
И наоборот, если вы уменьшаете внешнее давление (например, поднимаясь на большую высоту), вы понижаете температуру кипения. Вот почему вода кипит при более низкой температуре в Денвере, чем на уровне моря.
Влияние давления на плавление
Для большинства веществ увеличение давления незначительно повышает температуру плавления. Это связано с тем, что давление помогает удерживать молекулы в жесткой, плотно упакованной структуре твердого тела.
Вода — известный исключение. Поскольку твердый лед менее плотный, чем жидкая вода, приложение давления на самом деле облегчает его плавление. Вот почему лезвие фигуриста может скользить по льду.
Распространенные ошибки и нюансы
Простое рассмотрение одного фактора может ввести в заблуждение. Взаимодействие между силами, массой и формой создает важные нюансы.
Молекулярная масса против межмолекулярной силы
Хотя температура кипения, как правило, увеличивается с молярной массой, тип ММС гораздо более доминирующий.
Маленькая молекула с сильными водородными связями, такая как вода (18 г/моль, кипит при 100°C), будет иметь значительно более высокую температуру кипения, чем молекула аналогичного размера, имеющая только слабые дисперсионные силы, такая как метан (16 г/моль, кипит при -161,5°C).
Влияние молекулярной формы
Для молекул с одинаковой химической формулой (изомеров) форма имеет значение. Длинные, прямые молекулы имеют большую площадь поверхности для контакта, что приводит к более сильным лондоновским дисперсионным силам и более высоким температурам кипения.
Компактные, сферические молекулы имеют меньшую площадь поверхности и, следовательно, более слабое притяжение и более низкие температуры кипения.
Как сделать правильный прогноз
Объединив эти принципы, вы сможете точно оценить, почему разные вещества ведут себя так, как они себя ведут.
- Если ваше основное внимание уделяется сравнению различных веществ: Сначала определите самую сильную межмолекулярную силу, присутствующую в каждом из них; это почти всегда будет основным определяющим фактором их относительных температур кипения.
- Если ваше основное внимание уделяется изменению условий одного вещества: Проанализируйте, как изменения внешнего давления повлияют на энергию, необходимую для фазового перехода, особенно для кипения.
- Если вы столкнулись с неожиданным результатом: Учитывайте второстепенные факторы, такие как молекулярная форма или уникальные свойства плотности вещества, как это видно на примере воды.
Понимая эти основные принципы, вы сможете перейти от простого запоминания температур плавления и кипения к истинному пониманию физического поведения материи.
Сводная таблица:
| Фактор | Описание | Влияние на температуру плавления/кипения |
|---|---|---|
| Межмолекулярные силы (ММС) | Сила притяжения между молекулами. | Более сильные силы = Более высокая точка |
| Водородная связь | Сильная сила со связями H-F, H-O, H-N. | Очень высокая точка |
| Диполь-диполь | Умеренная сила между полярными молекулами. | Умеренная точка |
| Лондоновские дисперсионные | Слабая сила во всех молекулах, увеличивается с размером. | Низкая точка (если молекула не большая) |
| Внешнее давление | Давление, приложенное к веществу. | Больше давление = Выше температура кипения (обычно) |
Нужен точный контроль температуры для ваших лабораторных процессов? Понимание фазовых переходов имеет решающее значение для таких применений, как синтез материалов, химическая очистка и подготовка образцов. В KINTEK мы специализируемся на высококачественном лабораторном оборудовании, включая печи, муфельные печи и системы контроля температуры, разработанные для обеспечения точности и надежности, необходимых вашим исследованиям. Позвольте нашим экспертам помочь вам выбрать идеальное оборудование для вашего конкретного применения. Свяжитесь с нами сегодня, чтобы обсудить ваши лабораторные потребности!
Визуальное руководство
Связанные товары
- Печь для вакуумной термообработки и печь для индукционной плавки с левитацией
- Система вакуумного индукционного плавильного литья Дуговая плавильная печь
- Печь для вакуумной индукционной плавки лабораторного масштаба
- Автоматический гидравлический пресс с подогревом и нагревательными плитами для лабораторного горячего прессования 25Т 30Т 50Т
- Гидравлический пресс с подогревом и встроенными ручными нагревательными плитами для лабораторного использования
Люди также спрашивают
- В чем разница между пиролизом и каталитическим крекингом? Руководство по выбору процесса
- Насколько эффективен пиролиз пластика? Максимизация преобразования отходов в энергию
- Почему промышленный процесс производства титана такой дорогой? Высокая стоимость усмирения реактивного металла
- Что такое спеченный металл? Руководство по высокопрочным, сложным металлическим деталям
- Каковы области применения биоугля, полученного пиролизом? Разработайте его свойства для достижения вашей конкретной цели
- Каковы марки графита? Практическое руководство по выбору подходящего материала для вашего применения
- Каковы некоторые области применения ИК-Фурье спектроскопии? Идентификация материалов от фармацевтики до криминалистики
- Какова функция лабораторной прецизионной печи при подготовке GLYMO-rGO? Обеспечение оптимального диспергирования нанонаполнителя






















