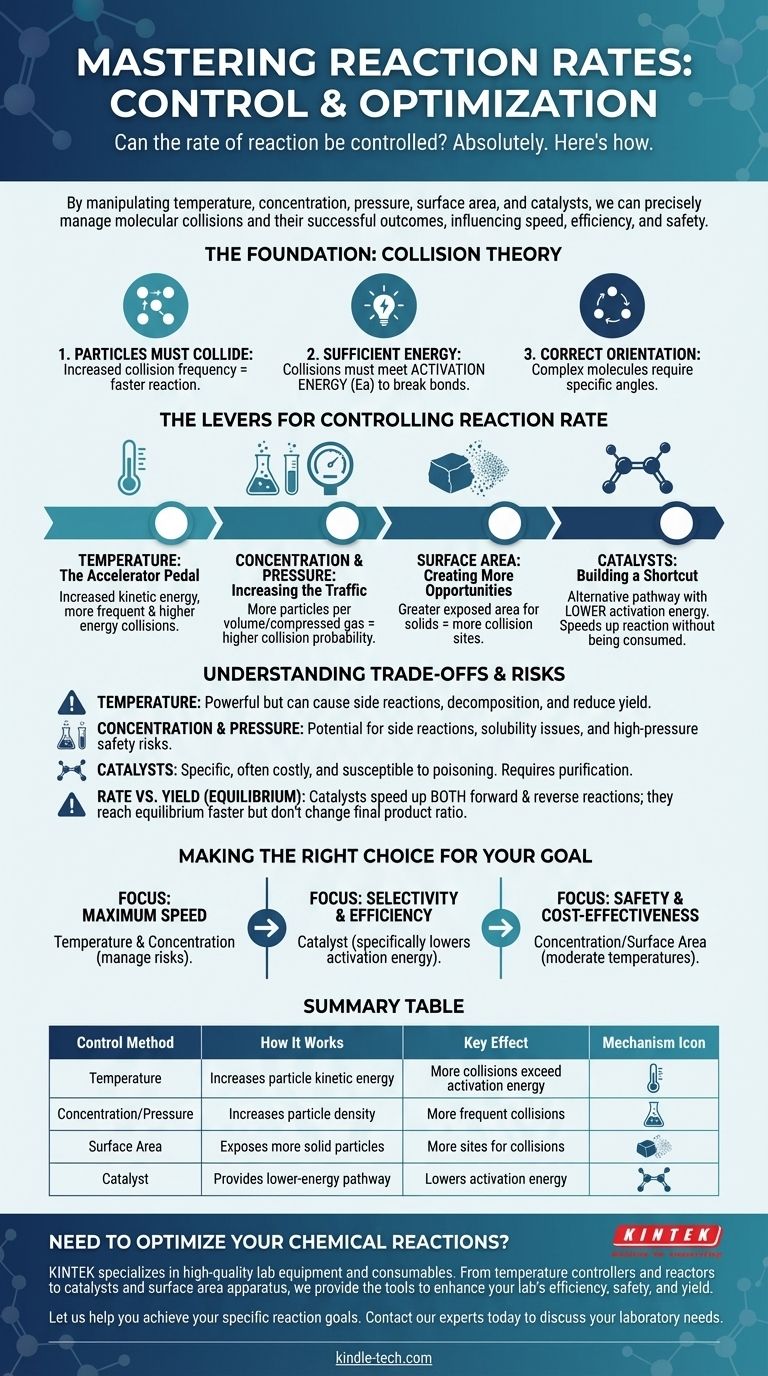
Абсолютно. Скорость химической реакции не является фиксированным свойством; ею можно точно управлять. Манипулируя определенными физическими и химическими факторами, мы можем намеренно ускорить, замедлить или даже остановить реакцию. Основными рычагами управления являются температура, концентрация реагентов, давление (для газов), площадь поверхности (для твердых веществ) и введение катализаторов.
Контроль скорости реакции по существу заключается в управлении частотой и энергией молекулярных столкновений. Каждый метод, от нагревания вещества до добавления катализатора, работает путем влияния на то, как часто сталкиваются частицы и являются ли эти столкновения успешными.

Основа: Теория столкновений
Чтобы контролировать реакцию, вы должны сначала понять, что заставляет ее происходить. Скорость любой реакции определяется принципами теории столкновений, которая гласит, что для протекания реакции должны быть выполнены три условия.
1. Частицы должны сталкиваться
Чтобы две или более молекулы прореагировали, они должны сначала физически соприкоснуться. Чем чаще сталкиваются частицы, тем больше у них возможностей для реакции, что увеличивает скорость реакции.
2. Столкновения должны обладать достаточной энергией
Простого столкновения недостаточно. Сталкивающиеся частицы должны обладать минимальным количеством суммарной кинетической энергии, известной как энергия активации (Ea). Эта энергия необходима для разрыва существующих химических связей, чтобы могли образоваться новые.
Столкновения с энергией ниже энергии активации будут безуспешными; частицы просто отскочат друг от друга без изменений.
3. Частицы должны иметь правильную ориентацию
Для сложных молекул столкновение также должно происходить под определенным углом или ориентацией. Если реакционноспособные части молекул не выстраиваются должным образом во время столкновения, реакция не произойдет, даже если требование к энергии выполнено.
Рычаги управления скоростью реакции
Понимание теории столкновений дает нам четкую дорожную карту для манипулирования скоростью реакции. Каждый метод управления работает путем изменения одного или нескольких условий, необходимых для успешного столкновения.
Температура: Педаль акселератора
Повышение температуры увеличивает среднюю кинетическую энергию частиц. Это имеет мощный двойной эффект.
Во-первых, это заставляет частицы двигаться быстрее, что приводит к более частым столкновениям. Во-вторых, и это более важно, это означает, что гораздо большая доля этих столкновений будет иметь энергию, равную или превышающую энергию активации, что резко увеличивает скорость успешных реакций.
Концентрация и давление: Увеличение трафика
Увеличение концентрации реагентов в растворе означает, что в том же объеме упаковано больше частиц. Это напрямую увеличивает вероятность столкновения, тем самым повышая скорость реакции.
Для газов увеличение давления имеет тот же эффект. Оно сближает молекулы газа, эффективно увеличивая их концентрацию и приводя к более частым столкновениям.
Площадь поверхности: Создание большего количества возможностей
Этот фактор имеет решающее значение, когда твердое вещество реагирует с жидкостью или газом. Разделяя твердое вещество на более мелкие части (например, из твердого куска в порошок), вы резко увеличиваете его общую площадь поверхности.
Это обнажает больше частиц твердого вещества для другого реагента, создавая гораздо больше мест, где могут происходить столкновения, и увеличивая общую скорость реакции.
Катализаторы: Создание короткого пути
Катализатор — это вещество, которое увеличивает скорость реакции, не расходуясь в процессе. Он работает, предоставляя альтернативный путь реакции с более низкой энергией активации.
Катализатор не заставляет частицы сталкиваться чаще или с большей энергией. Вместо этого он снижает энергетический «барьер», который должно преодолеть столкновение, чтобы быть успешным, что значительно облегчает протекание реакции.
Понимание компромиссов и рисков
Хотя эти рычаги эффективны, они не лишены последствий. Выбор правильного метода требует понимания их ограничений и потенциальных недостатков.
Грубая сила температуры
Нагрев — мощный, но неразборчивый инструмент. Хотя он ускорит желаемую реакцию, он также ускорит любые потенциальные побочные реакции. При очень высоких температурах он может даже вызвать разложение реагентов или продуктов, снижая общий выход.
Опасности концентрации и давления
Высокие концентрации иногда могут приводить к нежелательным побочным реакциям или проблемам с растворимостью. Что более критично, работа при очень высоком давлении требует специализированного, дорогостоящего и прочного оборудования для управления значительными рисками безопасности при возможном нарушении герметичности.
Специфичность и стоимость катализаторов
Катализаторы часто очень специфичны и могут быть очень дорогими (например, те, которые используют платину или палладий). Они также могут быть выведены из строя примесями, процесс, известный как отравление катализатора, что требует тщательной очистки реагентов.
Скорость против выхода (равновесие)
Важно различать скорость реакции и выход реакции. Для обратимых реакций, которые могут протекать как в прямом, так и в обратном направлении, катализатор ускоряет обе реакции одинаково. Это означает, что вы достигнете равновесия быстрее, но это не изменит конечного соотношения продуктов к реагентам.
Принятие правильного решения для вашей цели
Оптимальная стратегия контроля реакции полностью зависит от вашей конкретной цели, будь то скорость, эффективность или безопасность.
- Если ваш главный приоритет — максимальная скорость: Увеличение температуры и концентрации — ваши самые прямые инструменты, но вы должны активно управлять рисками побочных реакций и угроз безопасности.
- Если ваш главный приоритет — селективность и эффективность: Катализатор часто является лучшим выбором, поскольку он может специфически снизить энергию активации для желаемой реакции, не способствуя другим.
- Если ваш главный приоритет — безопасность и экономическая эффективность: Манипулирование концентрацией или площадью поверхности при умеренных температурах часто является наиболее доступным и наименее рискованным методом.
Освоение этих факторов позволяет превратить химические реакции из фиксированных событий в динамические процессы, которыми можно точно управлять для достижения конкретного результата.
Сводная таблица:
| Метод контроля | Как это работает | Ключевой эффект |
|---|---|---|
| Температура | Увеличивает кинетическую энергию частиц | Больше столкновений превышает энергию активации |
| Концентрация/Давление | Увеличивает плотность частиц | Более частые столкновения |
| Площадь поверхности | Обнажает больше частиц твердого реагента | Больше мест для столкновений |
| Катализатор | Обеспечивает путь реакции с более низкой энергией | Снижает энергию активации |
Нужна оптимизация ваших химических реакций?
Точный контроль скорости реакции является ключом к успешной лабораторной работе. Независимо от того, нужно ли вам ускорить синтез, улучшить селективность или обеспечить безопасную эксплуатацию, правильное оборудование имеет решающее значение.
KINTEK специализируется на предоставлении высококачественного лабораторного оборудования и расходных материалов, чтобы помочь вам освоить эти переменные. От прецизионных контроллеров температуры и реакторов для управления теплом и давлением до широкого спектра катализаторов и аппаратов, предназначенных для оптимального взаимодействия с поверхностью — у нас есть инструменты для повышения эффективности, безопасности и выхода вашей лаборатории.
Позвольте нам помочь вам достичь ваших конкретных целей реакции. Свяжитесь с нашими экспертами сегодня, чтобы обсудить ваши лабораторные потребности и найти идеальное решение.
Визуальное руководство
Связанные товары
- Настраиваемые реакторы высокого давления для передовых научных и промышленных применений
- Настраиваемые лабораторные реакторы высокого давления и высокой температуры для различных научных применений
- Миниавтоклав высокого давления из нержавеющей стали для лабораторного использования
- Автоклавный реактор для гидротермального синтеза высокого давления
- Установка изостатического прессования при повышенной температуре WIP 300 МПа для применений под высоким давлением
Люди также спрашивают
- Какова цель использования высокотемпературного гидротермального реактора? Улучшение синтеза катода с йодом на активированном угле
- Какую роль играют автоклавы в синтезе цеолитов типа MFI? Мастер гидротермального кристаллического роста
- Какова функция реактора гидротермального синтеза с постоянной температурой? Активация золы уноса угля
- Какова роль реакторов высокого давления в изучении окисления сплавов? Основные инструменты для исследований в сверхкритических условиях
- Каков вклад гидротермального реактора в создание градуированных пор? Точные шаблоны для TAS



















