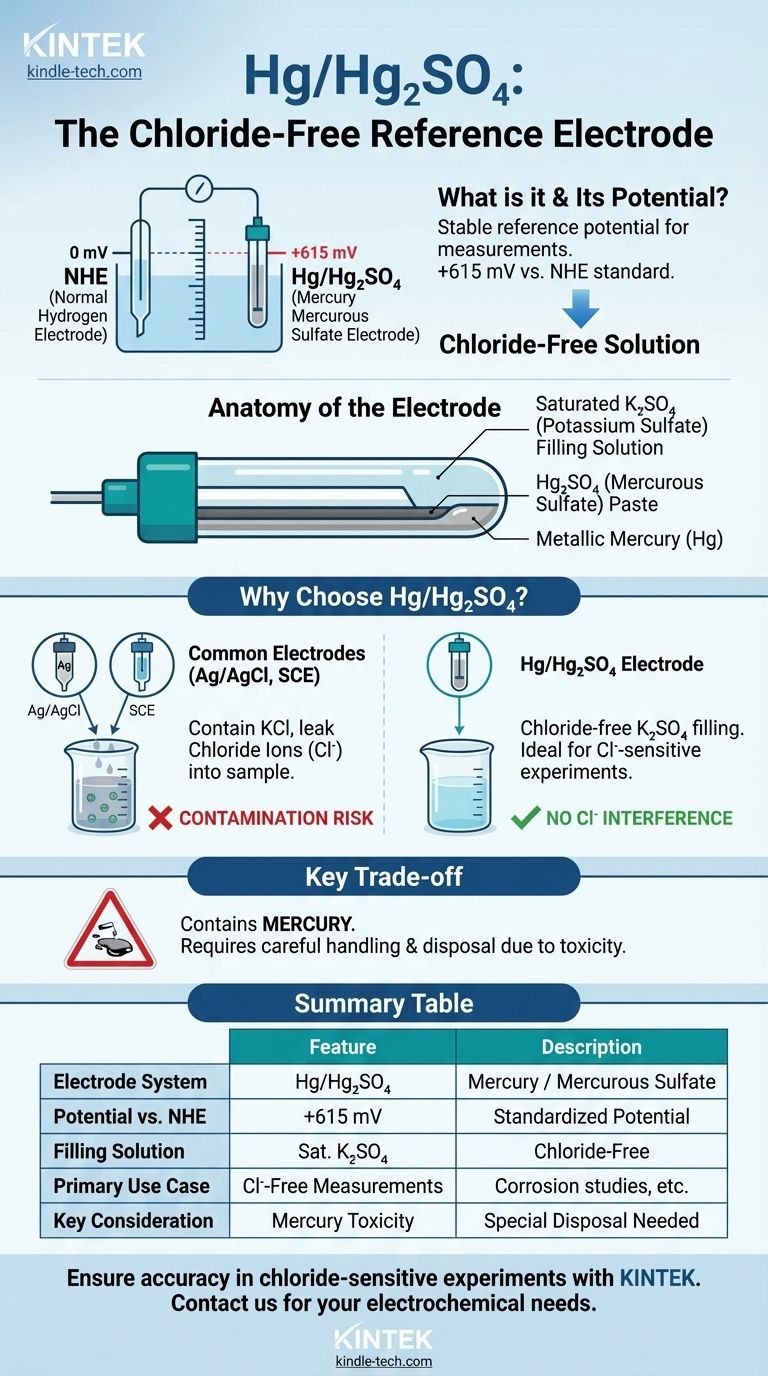
Технически, система ртуть/сульфат ртути(I) (Hg/Hg₂SO₄) сама по себе является электродом сравнения. Ее цель — обеспечить стабильный, известный электрохимический потенциал, относительно которого измеряются другие потенциалы. Стандартом, к которому он приводится, является Нормальный водородный электрод (НВЭ), относительно которого потенциал электрода Hg/Hg₂SO₄ составляет +615 мВ.
Электрод Hg/Hg₂SO₄ — это специализированный электрод сравнения, не содержащий хлоридов. Он используется в электрохимических приложениях, где загрязнение хлорид-ионами от более распространенных электродов, таких как Ag/AgCl или каломельный, может помешать измерению или повредить образец.

Роль электрода сравнения
Необходимость стабильной базовой линии
В электрохимии мы можем измерить только разность потенциалов между двумя точками, а не абсолютный потенциал. Электрод сравнения служит одной из этих точек, обеспечивая постоянный, стабильный потенциал.
Это позволяет с уверенностью отнести любое изменение измеряемого напряжения к реакции, происходящей на другом электроде, известном как рабочий электрод.
Универсальный стандарт: НВЭ
Вся электрохимическая шкала стандартизирована относительно Нормального водородного электрода (НВЭ), которому по определению присвоен потенциал 0,000 вольт. Все остальные потенциалы электродов сравнения, включая Hg/Hg₂SO₄, приводятся относительно этого универсального стандарта.
Устройство электрода Hg/Hg₂SO₄
Основные компоненты
Электрод состоит из металлической ртути (Hg) в непосредственном контакте с пастой сульфата ртути(I) (Hg₂SO₄). Это равновесие обеспечивает стабильный потенциал.
Электролит без хлоридов
Его определяющей характеристикой является электролит, которым обычно является насыщенный сульфат калия (K₂SO₄). Это принципиально отличается от раствора хлорида калия (KCl), используемого в более распространенных электродах сравнения.
Его стандартный потенциал
Установленный потенциал электрода ртуть/сульфат ртути(I) составляет +0,615 В (или +615 мВ) по сравнению с НВЭ. Это значение имеет решающее значение для преобразования ваших экспериментальных измерений в стандартизированную шкалу.
Почему выбирают Hg/Hg₂SO₄?
Проблема загрязнения хлоридами
Два наиболее распространенных электрода сравнения — это серебро/хлорид серебра (Ag/AgCl) и насыщенный каломельный электрод (НКЭ). Оба используют насыщенный раствор хлорида калия (KCl).
Небольшое количество этого раствора неизбежно просачивается из кончика электрода в тестируемый образец. Для многих экспериментов это не проблема.
Когда использовать сульфатный электрод сравнения
Однако, если ваш эксперимент чувствителен к хлорид-ионам (Cl⁻), эта утечка может сделать ваши результаты недействительными. Электрод Hg/Hg₂SO₄ является основным решением для этих «бесхлоридных» применений.
Это особенно важно в таких областях, как исследования коррозии, где хлорид является известным агентом точечной коррозии, или в растворах, где хлорид-ионы могут выпадать в осадок с другими ионами в вашем образце.
Понимание компромиссов
Токсичность и утилизация
Как и каломельный электрод (НКЭ), электрод Hg/Hg₂SO₄ содержит ртуть. Это создает значительные проблемы с токсичностью и экологической утилизацией, что делает его непригодным для использования в пищевой, напиточной или некоторых экологических исследованиях.
Меньшая распространенность
По сравнению с почти вездесущим электродом Ag/AgCl, Hg/Hg₂SO₄ является более специализированным и менее распространенным оборудованием.
Сделайте правильный выбор для вашего эксперимента
Ваш выбор электрода сравнения имеет решающее значение для обеспечения точности и целостности ваших данных.
- Если ваше основное внимание уделяется общей водной электрохимии: Электрод Ag/AgCl является наиболее распространенным, надежным и удобным выбором для большинства применений.
- Если ваш эксперимент чувствителен к хлорид-ионам или включает ионы серебра: Электрод Hg/Hg₂SO₄ является отраслевым стандартом для предотвращения загрязнения хлоридами.
- Если вам необходимо избежать как ртути, так и хлорида: Возможно, вам придется изучить еще более специализированные электроды, такие как медно-сульфатный электрод (Cu/CuSO₄), в зависимости от вашей конкретной химической системы.
В конечном счете, лучший электрод сравнения — это тот, который обеспечивает стабильный потенциал, не вмешиваясь в химию, которую вы намереваетесь изучать.
Сводная таблица:
| Ключевая особенность | Описание |
|---|---|
| Система электрода | Ртуть / Сульфат ртути(I) (Hg/Hg₂SO₄) |
| Потенциал относительно НВЭ | +615 мВ |
| Электролит | Насыщенный сульфат калия (K₂SO₄) |
| Основной сценарий использования | Электрохимические измерения без хлоридов |
| Главное преимущество | Предотвращает загрязнение хлорид-ионами от обычных электродов |
| Ключевое соображение | Содержит ртуть; требует осторожного обращения и утилизации |
Обеспечьте точность ваших экспериментов, чувствительных к хлоридам, с помощью правильного оборудования.
Выбор правильного электрода сравнения имеет решающее значение для получения достоверных результатов. Электрод Hg/Hg₂SO₄ необходим для применений в исследованиях коррозии и в других сценариях, где необходимо избежать загрязнения хлоридами.
KINTEK специализируется на лабораторном оборудовании и расходных материалах, удовлетворяя все ваши лабораторные потребности. Наши эксперты могут помочь вам выбрать идеальный электрод сравнения для вашей конкретной электрохимической установки.
Свяжитесь с нами сегодня через нашу [#ContactForm], чтобы обсудить ваше применение и найти идеальное решение для ваших исследований.
Визуальное руководство
Связанные товары
- Каломельный, хлорсеребряный, сульфатно-ртутный электрод сравнения для лабораторного использования
- Вращающийся платиновый дисковый электрод для электрохимических применений
- Электрод из металлического диска Электрохимический электрод
- Золотой дисковый электрод
- Сульфатно-медный электрод сравнения для лабораторного использования
Люди также спрашивают
- Что такое ртутно-хлоридный ртутный электрод сравнения? Откройте для себя насыщенный каломельный электрод (НКЭ)
- Почему и как следует калибровать электроды электролитической ячейки? Обеспечение надежных результатов
- Каковы четыре основных типа датчиков? Руководство по источнику питания и типу сигнала
- Почему насыщенный каломельный электрод (НКЭ) используется в качестве электрода сравнения в исследованиях микробных топливных элементов?
- Почему каломельный электрод используется в качестве вторичного электрода сравнения? Практическое руководство по стабильным измерениям



















