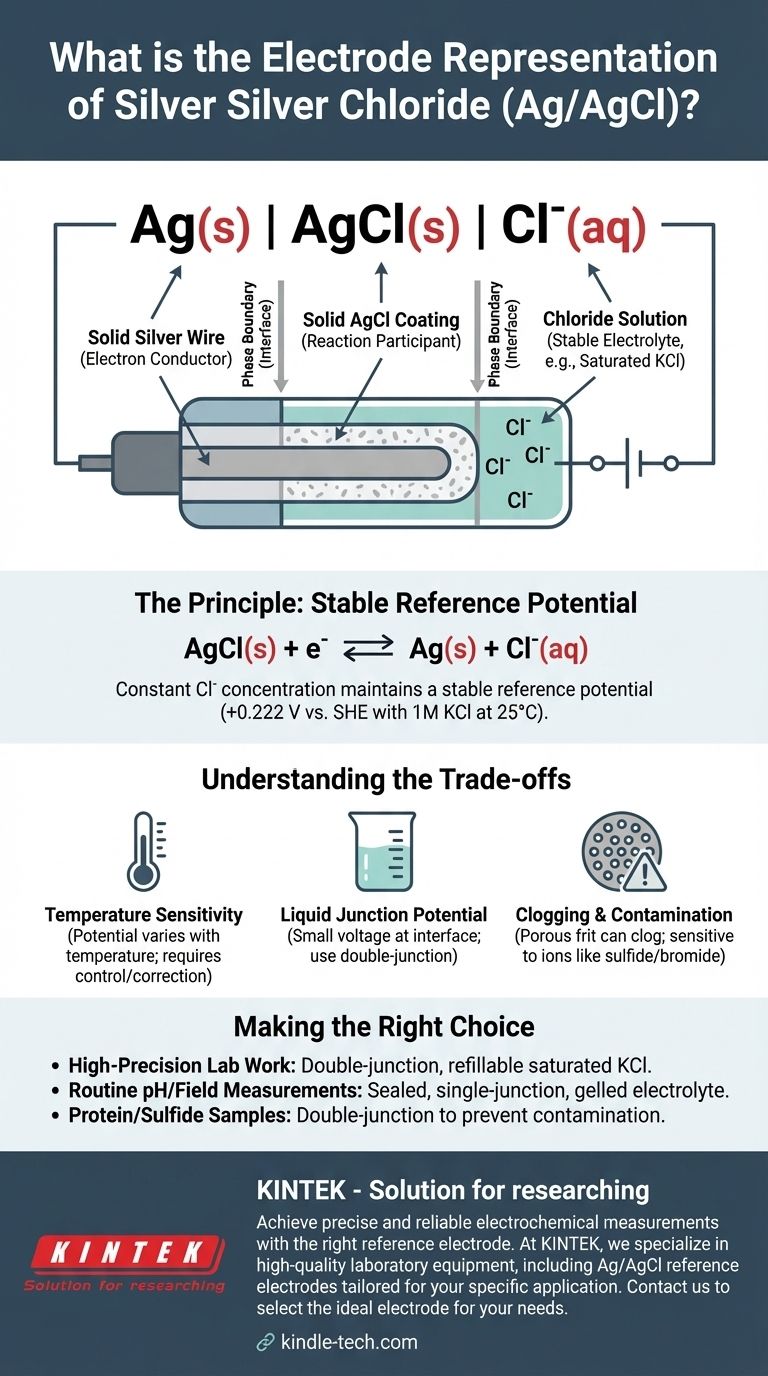
Стандартное сокращенное представление электрода серебро-хлорид серебра — это Ag(s) | AgCl(s) | Cl⁻(aq). Эта электрохимическая нотация описывает физические и химические фазы электрода: от твердого серебряного металла до водного раствора, содержащего ионы хлорида. Конкретный потенциал электрода критически зависит от концентрации этих ионов хлорида.
Эта нотация — больше, чем просто техническая метка; это схема одного из самых надежных и распространенных электродов сравнения в электрохимии. Она описывает систему, предназначенную для поддержания постоянного, стабильного потенциала, обеспечивая фиксированную базовую линию, относительно которой можно точно измерять потенциалы других электродов.

Деконструкция нотации электрода
Представление Ag(s) | AgCl(s) | Cl⁻(aq) подробно описывает структуру электрода изнутри наружу. Каждый компонент и символ имеет точное значение.
Твердая фаза: Ag(s)
Это представляет собой твердый серебряный провод. Этот провод служит проводником электронов, соединяя электрод с внешней измерительной схемой (вольтметром или потенциостатом).
Граница раздела фаз: |
Одиночная вертикальная черта | обозначает границу раздела фаз. Она указывает на интерфейс, где встречаются два разных физических состояния, в данном случае — твердый металлический серебро и твердый слой хлорида серебра.
Слой нерастворимой соли: AgCl(s)
Это обозначает слой твердого, малорастворимого хлорида серебра, который нанесен непосредственно на поверхность серебряного провода. Этот слой является сердцем функции электрода, непосредственно участвуя в электрохимической реакции.
Вторая граница раздела фаз: |
Вторая вертикальная черта обозначает границу между твердым покрытием из хлорида серебра и окружающим его водным электролитным раствором.
Электролитный раствор: Cl⁻(aq)
Это представляет собой водный раствор, в который погружен покрытый провод. Этот раствор должен содержать известную и постоянную концентрацию ионов хлорида (Cl⁻). Обычно используется раствор хлорида калия (KCl), часто с определенной концентрацией, например, 1 М или, чаще всего, насыщенный раствор.
Принцип электрода сравнения
Электрод Ag/AgCl ценится не за его реакцию, а за его стабильность. Он обеспечивает постоянное напряжение, которое служит надежной нулевой точкой для других измерений.
Управляющая реакция
Стабильный потенциал устанавливается обратимым равновесием между твердыми компонентами и ионами хлорида в растворе. Полуреакция выглядит так:
AgCl(s) + e⁻ ⇌ Ag(s) + Cl⁻(aq)
Пока концентрация (точнее, активность) ионов хлорида в растворе остается постоянной, потенциал этой полуячейки не изменится.
Важность постоянной концентрации хлорида
Использование насыщенного раствора KCl гарантирует, что концентрация Cl⁻ постоянна и воспроизводима. Если часть воды испаряется, просто растворяется больше соли KCl для поддержания насыщения. Вот почему потенциал сравнения настолько стабилен. Для раствора KCl с концентрацией 1М при 25°C (298 К) этот потенциал составляет +0,222 В относительно Стандартного водородного электрода (SHE).
Понимание компромиссов
Хотя электрод Ag/AgCl очень надежен, он не лишен ограничений, которые необходимо учитывать при точной работе.
Температурная чувствительность
Потенциал электрода является функцией температуры. Для высокоточных измерений необходимо контролировать температуру ячейки или вносить поправки в измеренные потенциалы с учетом колебаний температуры.
Потенциал жидкостного соединения
Когда раствор KCl электрода вступает в контакт с другим образцом раствора, на границе раздела может развиваться небольшое напряжение, известное как потенциал жидкостного соединения. Это вносит небольшую, но систематическую ошибку в измерение, которую можно минимизировать с помощью электрода с двойным соединением.
Засорение и загрязнение
Пористая перегородка, обеспечивающая электрический контакт между внутренним раствором и образцом, может засориться. Она также может быть загрязнена ионами из образца (такими как сульфид, бромид или йодид), которые могут реагировать с серебром, вызывая дрейф потенциала электрода с течением времени.
Сделайте правильный выбор для вашего измерения
Ваше применение определяет, какая конфигурация электрода является наилучшей.
- Если ваш основной фокус — высокоточное лабораторное исследование: Используйте электрод сравнения Ag/AgCl с двойным соединением и пополняемым насыщенным раствором KCl для минимизации потенциала соединения и обеспечения простоты обслуживания.
- Если ваш основной фокус — рутинное измерение pH или полевые измерения: Герметичный электрод с одинарным соединением и гелеобразным электролитом долговечен, не требует сложного обслуживания и вполне достаточен.
- Если ваш основной фокус — анализ образцов, содержащих белки или сульфиды: Вы должны использовать электрод с двойным соединением, чтобы предотвратить засорение и загрязнение основного эталонного соединения.
Понимание этой нотации превращает ее из загадочной метки в функциональную схему для надежного электрохимического измерения.
Сводная таблица:
| Компонент | Символ | Описание |
|---|---|---|
| Твердый серебряный провод | Ag(s) | Проводник, подключаемый к внешней цепи. |
| Покрытие из хлорида серебра | AgCl(s) | Слой нерастворимой соли, обеспечивающий обратимую реакцию. |
| Раствор ионов хлорида | Cl⁻(aq) | Водный электролит (например, KCl) с постоянной концентрацией Cl⁻. |
| Граница раздела фаз |
Достигайте точных и надежных электрохимических измерений с правильным электродом сравнения.
В KINTEK мы специализируемся на высококачественном лабораторном оборудовании, включая ряд электродов сравнения Ag/AgCl, адаптированных для ваших конкретных применений — независимо от того, требуются ли вам высокоточные модели с двойным соединением для чувствительных лабораторных работ или долговечные, не требующие сложного обслуживания варианты для рутинного анализа.
Наши эксперты помогут вам выбрать идеальный электрод, чтобы обеспечить стабильный потенциал, минимизировать ошибки и повысить точность ваших исследований.
Свяжитесь с KINTEK сегодня, чтобы обсудить ваши лабораторные потребности и узнать, как наши надежные расходные материалы и оборудование могут поддержать вашу работу.
Визуальное руководство
Связанные товары
- Каломельный, хлорсеребряный, сульфатно-ртутный электрод сравнения для лабораторного использования
- Электрод из металлического диска Электрохимический электрод
- Вращающийся платиновый дисковый электрод для электрохимических применений
- Золотой дисковый электрод
- Вращающийся дисковый (кольцевой) электрод RRDE / совместим с PINE, японским ALS, швейцарским Metrohm, стеклоуглеродным платиновым
Люди также спрашивают
- Какой электрод используется в качестве эталонного? Руководство по точным электрохимическим измерениям
- Почему каломельный электрод используется в качестве вторичного электрода сравнения? Практическое руководство по стабильным измерениям
- Какой электрод сравнения используется для ртуть/сульфата ртути(I)? Руководство по электрохимии без хлоридов
- Что такое ртутно-хлоридный ртутный электрод сравнения? Откройте для себя насыщенный каломельный электрод (НКЭ)
- Каковы характеристики насыщенного каломельного электрода для нейтральных растворов? Понимание его стабильности и ограничений.



















