В химической технологии повышение давления в реакторе принципиально достигается путем манипулирования переменными закона идеального газа (PV=nRT). Наиболее распространенные методы включают введение большего количества материала (газа), повышение температуры системы или механическое уменьшение объема реактора. Каждый метод служит определенной цели и имеет значительные последствия для кинетики реакции, равновесия и общей безопасности.
Основная задача заключается не просто в том, как повысить давление, а в том, зачем вы это делаете. Выбор правильного метода полностью зависит от того, направлено ли ваше стремление на увеличение концентрации реагентов, смещение химического равновесия или контроль фазы материалов внутри реактора.

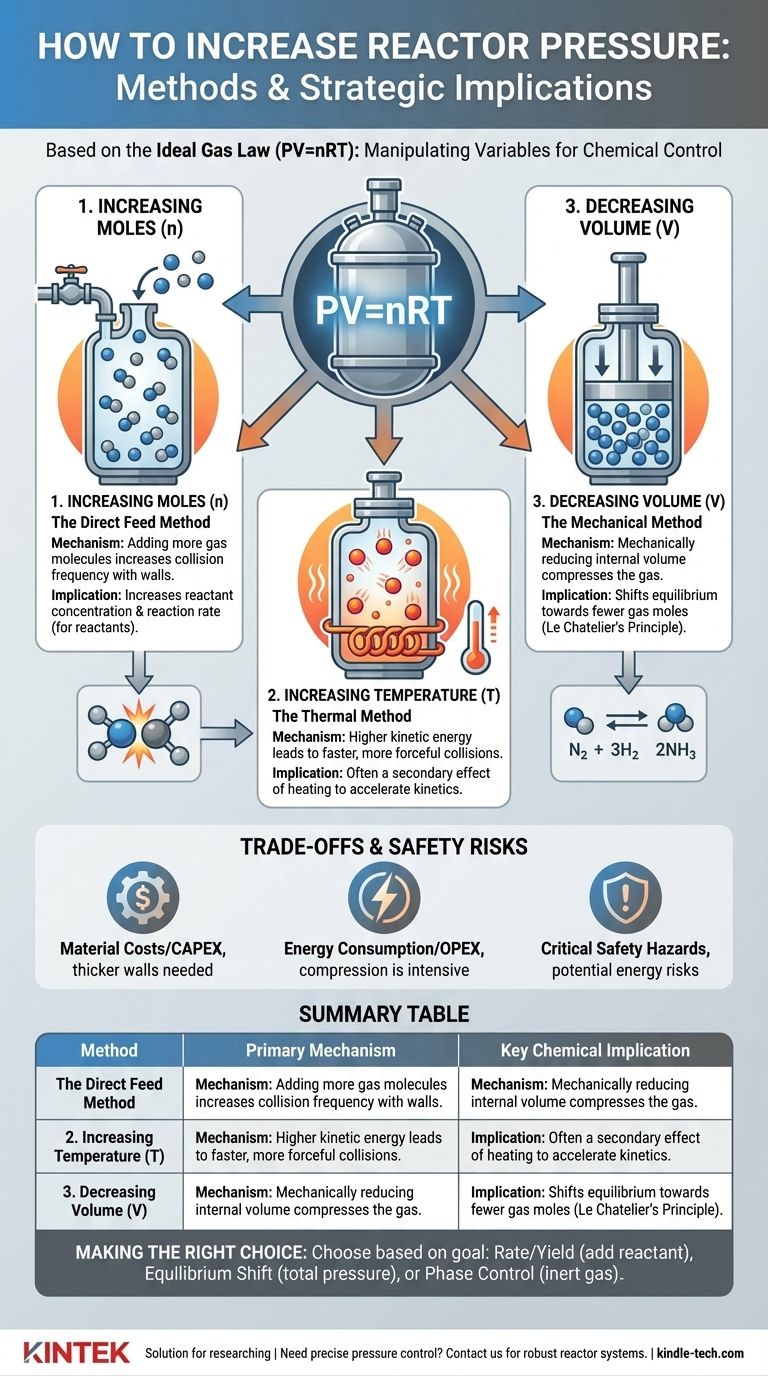
Основные принципы создания давления
По своей сути, давление является результатом столкновений молекул газа со стенками сосуда. Чтобы увеличить это давление, необходимо сделать эти столкновения более частыми или более сильными. Закон идеального газа обеспечивает теоретическую основу того, как это делается.
Увеличение количества молей (n): Метод прямой подачи
Это самый простой подход. Добавляя больше молекул газа в фиксированный объем, вы увеличиваете количество столкновений со стенками реактора, тем самым повышая давление.
Однако существует критическое различие между добавлением реагента и добавлением инертного газа. Добавление большего количества газообразного реагента увеличивает его парциальное давление, что напрямую повышает его концентрацию и может ускорить скорость реакции.
И наоборот, добавление инертного газа (например, азота или аргона) увеличивает общее давление в системе, но не изменяет парциальные давления реагентов. Этот метод часто используется для контроля фазового поведения или для теплового управления, а не для прямого влияния на скорость реакции.
Повышение температуры (T): Термический метод
Нагревание герметичного реактора увеличивает кинетическую энергию молекул газа внутри. Эти активированные молекулы движутся быстрее, что приводит к более частым и более сильным столкновениям со стенками реактора, что проявляется в увеличении давления.
Этот метод часто является вторичным эффектом проведения реакции при более высокой температуре для увеличения ее скорости. Увеличение давления должно быть предвидено и учтено в конструкции реактора.
Уменьшение объема (V): Механический метод
Для некоторых типов реакторов давление можно увеличить путем механического уменьшения внутреннего объема. Представьте себе поршень в цилиндре, сжимающий газ.
Этот метод менее распространен для крупномасштабных реакторов непрерывного действия, но является основным принципом в некоторых лабораторных установках, периодических процессах и определенных типах компрессоров или двигателей.
Химические последствия более высокого давления
Повышение давления — мощный инструмент, используемый для влияния на исход химической реакции и управления им. Это не просто физический параметр, а ключевой фактор химического поведения.
Влияние на скорость реакции
Для большинства газофазных реакций повышение давления путем добавления большего количества реагентов заставляет молекулы сближаться. Эта более высокая концентрация приводит к более частым молекулярным столкновениям, что, как правило, приводит к более быстрой скорости реакции.
Влияние на равновесие
Это регулируется принципом Ле Шателье. Если обратимая реакция имеет разное количество молей газа на стороне реагентов и продуктов, изменение давления сместит равновесие.
Повышение давления будет благоприятствовать той стороне реакции, где меньше молей газа. Классическим примером является процесс Габера-Боша для синтеза аммиака (N₂ + 3H₂ ⇌ 2NH₃), где высокое давление используется для смещения равновесия в сторону продукта, аммиака.
Влияние на фазовое поведение
Давление также является критически важным инструментом для контроля физического состояния веществ. Высокое давление может предотвратить кипение жидкости даже при высоких температурах, что важно для многих жидкофазных реакций. Его также можно использовать для сжижения газов для разделения или для облегчения реакций, происходящих на границе раздела газ-жидкость.
Понимание компромиссов и рисков безопасности
Хотя более высокое давление может обеспечить значительные технологические преимущества, оно сопряжено со значительными затратами и опасностями, которыми необходимо тщательно управлять.
Затраты на материалы и строительство
Реакторы высокого давления требуют более толстых стальных стенок, более совершенных сплавов и высокоспециализированных уплотнений и фитингов для обеспечения герметичности. Это резко увеличивает первоначальные капитальные затраты (CAPEX) проекта.
Потребление энергии
Сжатие газов до высоких давлений — чрезвычайно энергоемкий процесс. Это напрямую приводит к увеличению текущих операционных расходов (OPEX) и может оказать существенное влияние на экономическую жизнеспособность процесса.
Критические риски безопасности
Самым важным соображением является безопасность. Система высокого давления хранит огромное количество потенциальной энергии. Разрушение или отказ могут привести к катастрофическому, взрывному выбросу.
Все системы высокого давления должны быть оснащены многоуровневой защитой, включая предохранительные клапаны, разрывные диски, а также строгие протоколы проверки и технического обслуживания для снижения этих рисков.
Сделайте правильный выбор для вашей цели
Правильный метод повышения давления определяется конкретной целью вашего химического процесса.
- Если ваша основная цель — увеличить скорость реакции и выход: Прямое добавление большего количества газообразного реагента является наиболее эффективной стратегией, поскольку оно увеличивает парциальные давления, которые управляют реакцией.
- Если ваша основная цель — сместить химическое равновесие: Повышение общего давления в системе, либо путем сжатия, либо путем добавления реагентов, имеет решающее значение для реакций, где побочный продукт имеет меньшее количество молей газа.
- Если ваша основная цель — поддерживать жидкую фазу выше ее нормальной температуры кипения: Увеличение общего давления, часто с помощью инертного газа, является ключом к созданию необходимых технологических условий.
В конечном счете, управление давлением в реакторе — это стратегическое манипулирование термодинамикой и кинетикой системы для достижения желаемого результата безопасно и эффективно.
Сводная таблица:
| Метод | Основной механизм | Ключевое химическое следствие |
|---|---|---|
| Увеличение количества молей (n) | Добавление большего количества молекул газа | Увеличивает концентрацию реагентов/скорость реакции |
| Повышение температуры (T) | Повышение кинетической энергии молекул | Вторичный эффект нагрева для ускорения реакций |
| Уменьшение объема (V) | Механическое сжатие газа | Смещает равновесие в сторону меньшего количества молей газа |
Нужен точный контроль давления для ваших лабораторных процессов? KINTEK специализируется на высококачественном лабораторном оборудовании и расходных материалах, включая надежные реакторные системы, разработанные для безопасного и эффективного управления давлением. Наши решения помогают вам достичь оптимальной кинетики реакции, выхода и безопасности. Свяжитесь с KINTEK сегодня, чтобы обсудить, как мы можем поддержать конкретные потребности вашей лаборатории.
Визуальное руководство
Связанные товары
- Настраиваемые лабораторные реакторы высокого давления и высокой температуры для различных научных применений
- Настраиваемые реакторы высокого давления для передовых научных и промышленных применений
- Лабораторный автоклав высокого давления горизонтальный паровой стерилизатор для лабораторного использования
- Автоклавный реактор для гидротермального синтеза высокого давления
- Лабораторный паровой стерилизатор высокого давления, вертикальный автоклав для лаборатории
Люди также спрашивают
- Какую роль играет автоклав из нержавеющей стали с футеровкой из ПТФЭ в синтезе прекурсорных нанолистов BiOBr?
- Каково преимущество использования высокотемпературных гидротермальных реакторов для переработки биомассы? Эффективное восстановление ресурсов
- Какова функция гидротермального автоклава с футеровкой из ПТФЭ в синтезе cys-CD? Достижение высокочистых углеродных точек
- Почему реакторы SCWG должны поддерживать определенную скорость нагрева? Защитите свои сосуды высокого давления от термических напряжений
- Какую роль играет реактор высокого давления в гидродезоксигенации (HDO) биомасла? Усовершенствование топлива



















