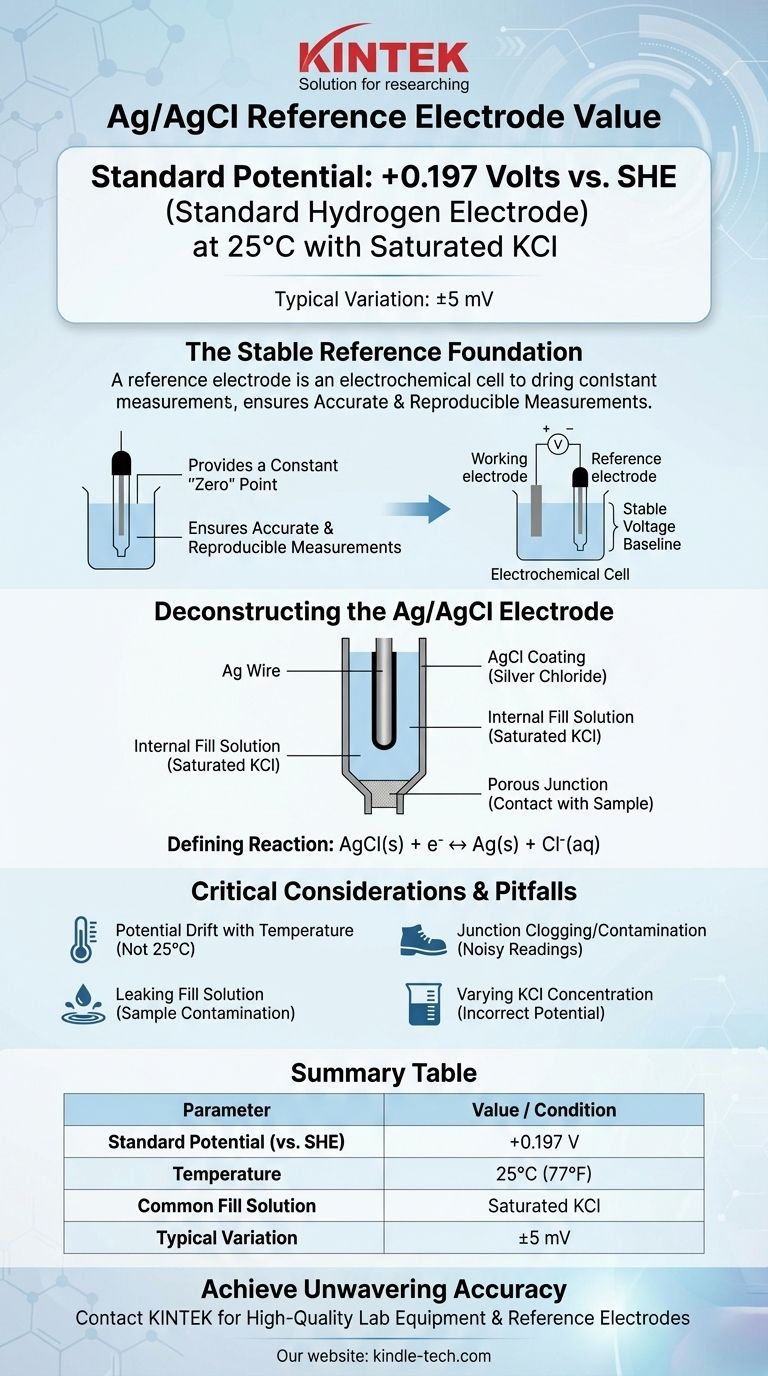
В своей наиболее распространенной конфигурации электрод сравнения серебро/хлорид серебра (Ag/AgCl) имеет потенциал +0,197 Вольт относительно стандартного водородного электрода (СВЭ) при 25°C. Это значение предполагает, что в электроде используется насыщенный раствор хлорида калия (KCl). Незначительные отклонения, часто указываемые как +199 мВ (±5 мВ), распространены из-за небольших различий в подготовке и условиях.
Основная функция электрода сравнения — обеспечивать неизменный, стабильный базовый уровень напряжения. Понимание того, что потенциал электрода Ag/AgCl определяется специфическим химическим равновесием и чувствителен к концентрации хлоридов и температуре, является ключом к его использованию для точных и воспроизводимых измерений.

Роль стабильного эталона
Установление нулевой точки
Все измерения напряжения по своей сути являются разностью потенциалов между двумя точками. В электрохимии невозможно измерить абсолютный потенциал одного рабочего электрода.
Электрод сравнения обеспечивает постоянный, известный потенциал, который служит стабильной «нулевой» точкой. Все остальные потенциалы в вашей электрохимической ячейке затем измеряются относительно этого неизменного эталона.
Как достигается стабильность
Идеальный электрод сравнения описывается как «хорошо сбалансированный». Это означает, что его потенциал определяется быстрой, обратимой химической реакцией, которая не сильно нарушается крошечным количеством тока, протекающего во время измерения.
Для электрода Ag/AgCl эта стабильность обусловлена равновесием между твердым хлоридом серебра и ионами серебра и хлорида.
Деконструкция электрода Ag/AgCl
Основные компоненты
Типичный электрод Ag/AgCl состоит из серебряной (Ag) проволоки, покрытой слоем твердого хлорида серебра (AgCl).
Вся эта сборка погружена во внутренний заполняющий раствор, содержащий известную, фиксированную концентрацию хлорид-ионов (Cl⁻), чаще всего хлорида калия (KCl). Пористый переход, часто изготовленный из керамики или хлопка, обеспечивает электрический контакт с исследуемым раствором.
Определяющая электрохимическая реакция
Потенциал электрода устанавливается простой и обратимой полуэлементной реакцией:
AgCl(тв) + e⁻ ↔ Ag(тв) + Cl⁻(водн)
Потенциал этого равновесия напрямую зависит от активности (по сути, концентрации) хлорид-ионов в заполняющем растворе.
Почему заполняющий раствор критически важен
Поскольку потенциал зависит от концентрации хлоридов, его значение должно быть фиксированным и известным.
Насыщенный KCl является наиболее распространенным выбором, потому что его легко приготовить и поддерживать. Пока присутствуют твердые кристаллы KCl, раствор остается насыщенным, обеспечивая постоянную активность хлоридов и, следовательно, стабильный потенциал +0,197 В.
Используются и другие концентрации, такие как 3M или 1M KCl, которые приводят к различным эталонным потенциалам.
Понимание компромиссов и подводных камней
Дрейф потенциала с температурой
Стандартный потенциал +0,197 В действителен только при 25°C (77°F). Потенциал электрода будет предсказуемо меняться с температурой. Для высокоточных работ эту температурную зависимость необходимо учитывать или контролировать.
Засорение и загрязнение перехода
Пористый переход является наиболее распространенной точкой отказа. Если он засоряется материалом образца или если внутренний электролит кристаллизуется внутри него, электрическое соединение нарушается, что приводит к шумящим или полностью нестабильным показаниям.
Утечка заполняющего раствора
Внутренний заполняющий раствор медленно вытекает через переход по задумке. Если ваш образец чувствителен к ионам хлорида или калия, эта утечка может вызвать загрязнение или нежелательные побочные реакции, мешая вашему измерению. В этих случаях может потребоваться электрод с двойным переходом и другим внешним электролитом.
Предположение о насыщенном KCl
Никогда не предполагайте, что ваш электрод Ag/AgCl использует насыщенный раствор KCl. Всегда проверяйте концентрацию заполняющего раствора, так как использование неверного эталонного потенциала в ваших расчетах является фундаментальным источником ошибки. Электрод с 3M KCl, например, имеет потенциал, близкий к +0,210 В относительно СВЭ.
Правильный выбор для вашей цели
Чтобы ваши измерения были надежными, вы должны относиться к своему электроду сравнения как к критически важному прибору.
- Если ваша основная цель — рутинный анализ (например, измерение pH): Используйте коммерческий герметичный электрод, правильно храните его в предназначенном для него растворе для хранения, чтобы переход оставался влажным, и заменяйте его, когда показания становятся нестабильными.
- Если ваша основная цель — высокоточные исследования (например, исследования коррозии): Всегда указывайте конкретный используемый электрод сравнения (например, Ag/AgCl, нас. KCl) вместе с вашими данными, отслеживайте дрейф и рассмотрите возможность его калибровки по свежеприготовленному стандарту.
- Если ваша основная цель — избежать загрязнения образца: Выберите электрод с двойным переходом или электрод с заполняющим раствором, который химически совместим с вашим образцом, чтобы предотвратить осаждение или помехи на жидкостном переходе.
Надежный электрод сравнения — основа любого точного электрохимического измерения.
Сводная таблица:
| Параметр | Значение / Условие |
|---|---|
| Стандартный потенциал (относительно СВЭ) | +0,197 В |
| Температура | 25°C (77°F) |
| Обычный заполняющий раствор | Насыщенный KCl |
| Типичное отклонение | ±5 мВ |
Добейтесь неизменной точности в вашей лаборатории
Ваши электрохимические измерения настолько надежны, насколько надежен ваш электрод сравнения. KINTEK специализируется на высококачественном лабораторном оборудовании и расходных материалах, предоставляя точные и стабильные электроды сравнения Ag/AgCl, необходимые вашей лаборатории для воспроизводимых результатов.
Позвольте нашим экспертам помочь вам выбрать идеальный электрод сравнения для вашего применения — будь то рутинный анализ или высокоточные исследования.
Свяжитесь с KINTEK сегодня, чтобы ваши измерения основывались на прочном фундаменте.
Визуальное руководство
Связанные товары
- Вращающийся платиновый дисковый электрод для электрохимических применений
- Сульфатно-медный электрод сравнения для лабораторного использования
- Золотой дисковый электрод
- Платиновый вспомогательный электрод для лабораторного использования
- Вращающийся дисковый (кольцевой) электрод RRDE / совместим с PINE, японским ALS, швейцарским Metrohm, стеклоуглеродным платиновым
Люди также спрашивают
- Какова общая роль платинового дискового электрода? Руководство по его основному использованию в качестве рабочего электрода
- Каковы эксплуатационные характеристики платиновых проволочных/стержневых электродов? Непревзойденная стабильность для вашей лаборатории
- Каково распространенное применение платинового проволочного/стержневого электрода? Основное руководство по противоэлектродам
- Каково применение RRDE? Получите количественные данные о катализаторах и реакциях
- Что такое метод вращающегося дискового электрода с кольцом? Раскройте секреты анализа реакций в реальном времени



















