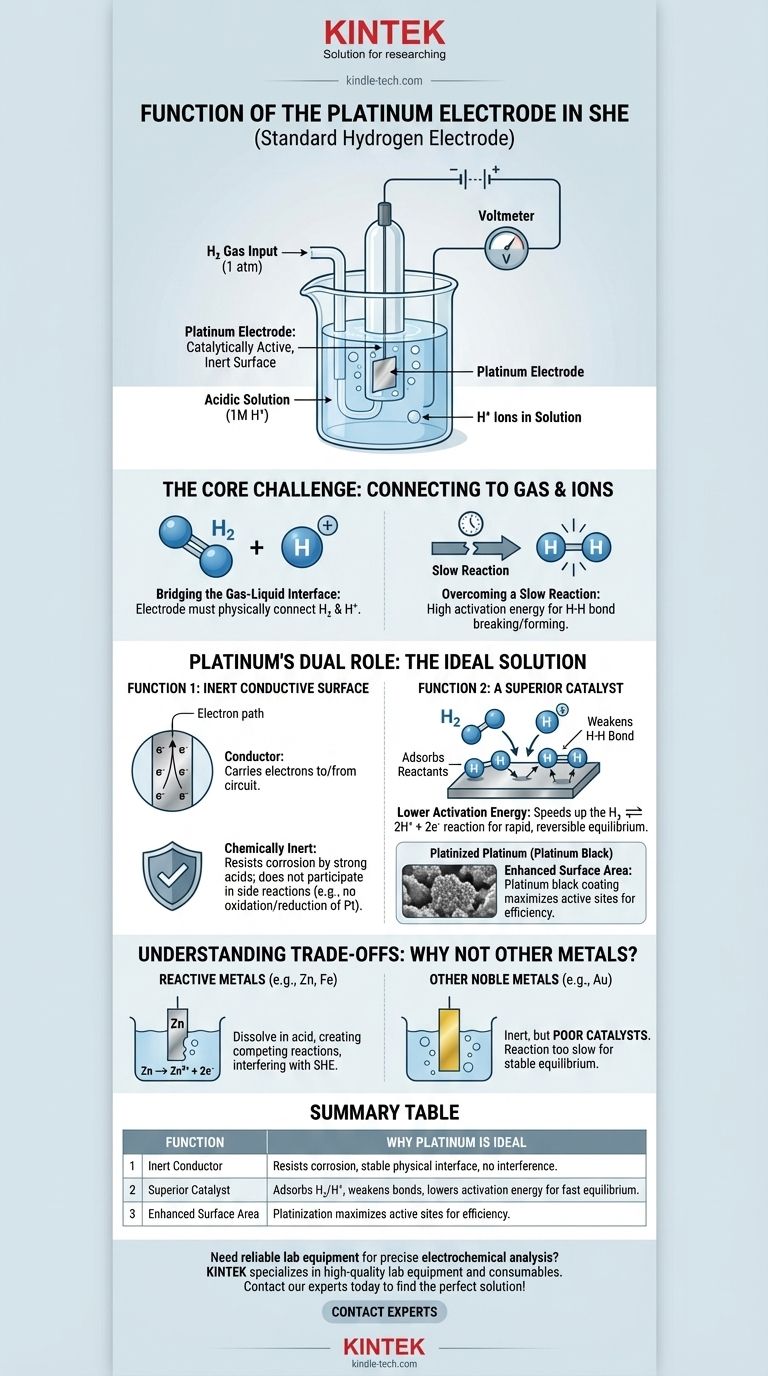
Короче говоря, платиновый электрод в стандартном водородном электроде (СВЭ) функционирует как каталитически активная, инертная поверхность. Он обеспечивает физическое место, где может происходить водородная реакция, и снижает требуемую энергию активации, позволяя ячейке достичь стабильного, измеримого равновесия без расхода самого электрода.
Основная задача СВЭ заключается в создании надежного электрического соединения для реакции, включающей газ (H₂) и ион (H⁺). Платина уникально подходит для этой роли, потому что она является как отличным катализатором для водородной реакции, так и химически инертным проводником, обеспечивая облегчение реакции без вмешательства в нее.

Основная задача: подключение цепи к газу
Чтобы понять функцию платины, мы должны сначала осознать фундаментальную проблему при конструировании стандартного водородного электрода. Цель состоит в измерении потенциала окислительно-восстановительной реакции водорода: 2H⁺(aq) + 2e⁻ ⇌ H₂(g).
Преодоление границы раздела газ-жидкость
Реакция включает ионы водорода, растворенные в кислом растворе, и газообразный водород, пропускаемый над электродом. Электрод должен физически находиться в этой среде, чтобы либо подавать, либо принимать электроны от внешней цепи.
Преодоление медленной реакции
Эта водородная реакция не происходит быстро или эффективно сама по себе. Энергия, необходимая для разрыва связи H-H в молекуле водорода или для объединения двух ионов водорода, высока. Без помощи система не достигла бы быстрого и обратимого равновесия, что сделало бы ее бесполезной в качестве стандартного эталона.
Двойная роль платины: идеальное решение
Платина выбрана потому, что она решает обе эти проблемы одновременно. Она действует как инертный физический проводник и как активный химический катализатор.
Функция 1: Инертная проводящая поверхность
Во-первых, электрод должен быть проводником для переноса электронов к внешней цепи или от нее. Крайне важно, чтобы он также был химически инертным.
Он не может реагировать с сильной кислотой (обычно 1М HCl) или сам окисляться или восстанавливаться. Платина — благородный металл, что означает ее чрезвычайную устойчивость к коррозии и растворению, что делает ее идеальной стабильной физической основой для электрода.
Функция 2: Превосходный катализатор
Это наиболее важная функция платины. Она значительно ускоряет окислительно-восстановительную реакцию водорода.
Поверхность платины адсорбирует как молекулы газообразного водорода (H₂), так и ионы водорода (H⁺). Представьте себе поверхность платины как рабочий стол, который удерживает реагенты на месте, облегчая их взаимодействие.
Адсорбируя газообразный водород, поверхность платины ослабляет прочную ковалентную связь H-H, что значительно облегчает расщепление молекулы на отдельные атомы, которые затем могут быть окислены до ионов H⁺. Это каталитическое действие позволяет реакции протекать быстро и обратимо.
Роль "платинированной платины"
Для максимизации этого эффекта электрод часто покрывают слоем мелкодисперсного платинового порошка, известного как платиновая чернь. Этот процесс, называемый платинированием, значительно увеличивает эффективную площадь поверхности электрода, предоставляя гораздо больше активных центров для катализа и обеспечивая эффективную работу электрода.
Понимание компромиссов: почему не другие металлы?
Изучение того, почему другие металлы не подходят, помогает понять, почему платина является окончательным выбором.
Проблема с реактивными металлами
Такие металлы, как цинк, железо или алюминий, очень реактивны. Если их поместить в кислый раствор СВЭ, они просто растворятся (Zn → Zn²⁺ + 2e⁻). Это создает конкурирующую электрохимическую реакцию, которая полностью помешает работе водородного электрода.
Проблема с другими благородными металлами
Другие инертные металлы, такие как золото, могли бы служить инертным проводником. Однако золото является значительно худшим катализатором для водородной реакции по сравнению с платиной. Хотя золотой электрод не будет корродировать, реакция будет слишком медленной для установления надежного и воспроизводимого равновесного потенциала, что лишает смысла использование "стандартного" электрода.
Правильный выбор для вашей цели
Понимание двойной функции платины является ключом к осмыслению фундаментальных принципов электрохимии и эталонных стандартов.
- Если ваше основное внимание сосредоточено на кинетике реакции: Помните, что основное назначение платины — действовать как гетерогенный катализатор, снижая энергию активации как для прямой, так и для обратной водородной реакции.
- Если ваше основное внимание сосредоточено на конструкции ячейки: Помните, что материал электрода должен быть инертным проводником, который обеспечивает стабильный физический интерфейс без участия в каких-либо мешающих побочных реакциях.
Выбор платины — это преднамеренное инженерное решение, которое позволяет водородному электроду служить универсальной нулевой точкой для всех электрохимических измерений.
Сводная таблица:
| Функция | Почему платина идеальна |
|---|---|
| Инертный проводник | Устойчив к коррозии в кислоте, обеспечивает стабильный физический интерфейс без мешающих реакций. |
| Превосходный катализатор | Адсорбирует H₂ и H⁺, ослабляет связи H-H и снижает энергию активации для быстрого, обратимого равновесия. |
| Увеличенная площадь поверхности | Платинирование (покрытие платиновой чернью) максимизирует активные центры для эффективной работы. |
Нужно надежное лабораторное оборудование для точного электрохимического анализа? KINTEK специализируется на высококачественном лабораторном оборудовании и расходных материалах, обеспечивая точные и стабильные результаты в вашей лаборатории. Свяжитесь с нашими экспертами сегодня, чтобы найти идеальное решение для ваших исследовательских нужд!
Визуальное руководство
Связанные товары
- Платиновая листовая электродная система для лабораторных и промышленных применений
- Каломельный, хлорсеребряный, сульфатно-ртутный электрод сравнения для лабораторного использования
- Вращающийся платиновый дисковый электрод для электрохимических применений
- Платиновый вспомогательный электрод для лабораторного использования
- Золотой дисковый электрод
Люди также спрашивают
- Как следует эксплуатировать платиновый листовой электрод во время эксперимента? Обеспечение точных и воспроизводимых результатов
- Каковы ключевые эксплуатационные характеристики и области применения платиновых листов? Непревзойденная надежность для требовательных применений
- Как следует предварительно обрабатывать платиновый дисковый электрод перед использованием? Обеспечьте точные электрохимические измерения
- Какие меры предосторожности следует соблюдать при использовании платинового листового электрода? Обеспечьте точные и воспроизводимые электрохимические данные
- Какое самое важное правило при погружении платинового дискового электрода в электролит? Обеспечьте точные электрохимические измерения



















