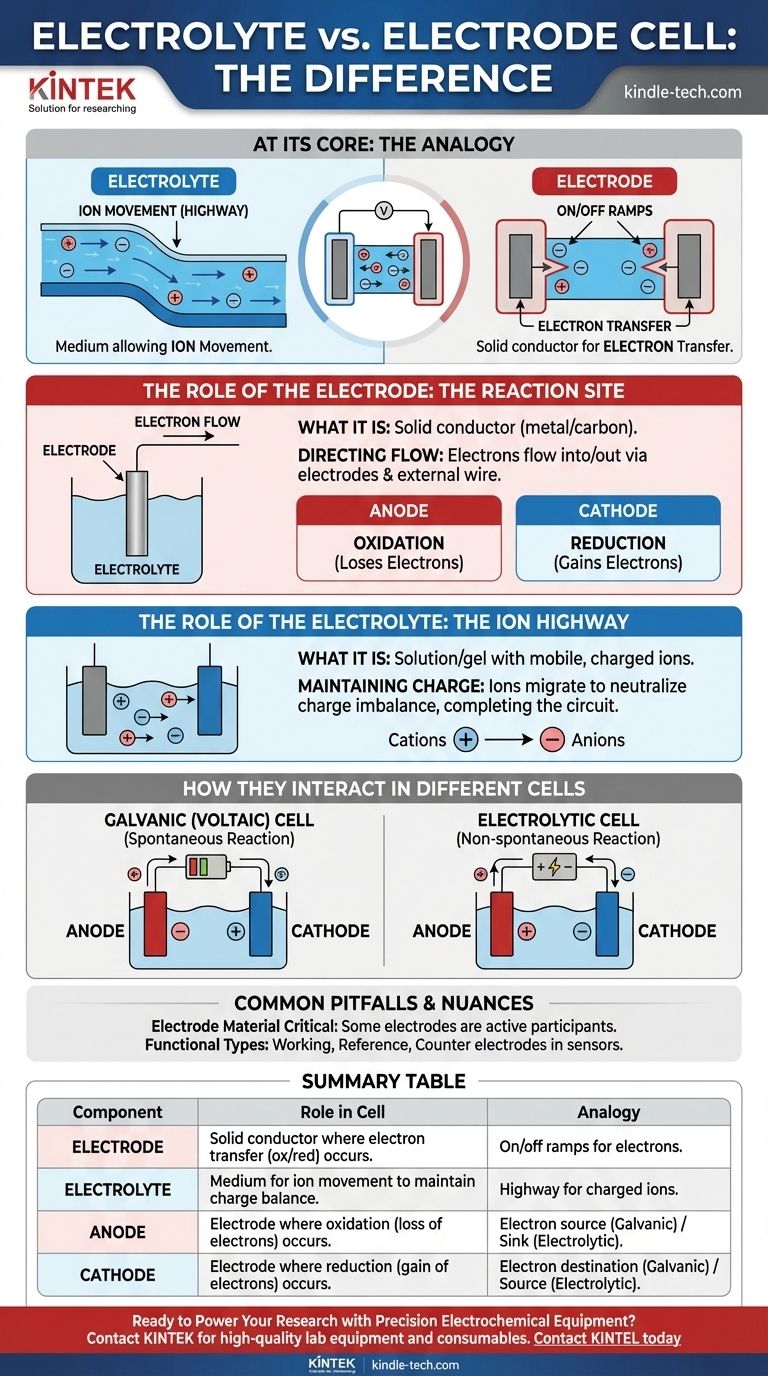
По сути, электролит — это среда, которая позволяет ионам двигаться, в то время как электрод — это физический проводник, где фактически происходит химическая реакция и перенос электронов. Электролит — это «магистраль» для заряженных ионов внутри ячейки, а электроды — это «въезды и съезды» с этой магистрали, соединяющие ее с внешней электрической цепью.
В любой электрохимической ячейке электроды представляют собой твердые проводники, на которых происходят химические реакции, либо высвобождающие, либо потребляющие электроны. Электролит — это необходимая жидкая или гелеобразная среда, которая транспортирует ионы между этими электродами, замыкая электрическую цепь.

Роль электрода: Место реакции
Электрод действует как физический интерфейс между химическими компонентами внутри ячейки и внешней электронной цепью.
Что такое электрод
Электрод представляет собой твердый электрический проводник, обычно металл или углерод, помещенный в электролит. Его задача — передавать электроны от частиц в растворе или к ним.
Управление потоком электронов
Электроны не могут проходить через электролит. Вместо этого они текут в ячейку или из нее через электроды и подключенный внешний провод.
Анод против Катода
Все ячейки имеют два типа электродов, определяемых реакцией, происходящей на их поверхности:
- Анод — это место, где происходит окисление (вещество теряет электроны).
- Катод — это место, где происходит восстановление (вещество приобретает электроны).
Роль электролита: Ионная магистраль
Электролит так же важен, как и электроды. Без него цепь не замкнута, и ток не может течь.
Что такое электролит
Электролит — это вещество, обычно раствор, содержащий соли, кислоты или основания, которое при растворении образует электропроводящий раствор. Он содержит подвижные заряженные ионы.
Поддержание электронейтральности
Поскольку электроны высвобождаются на аноде и потребляются на катоде, дисбаланс заряда быстро накапливается и останавливает реакцию. Электролит предотвращает это, позволяя своим ионам мигрировать между электродами, нейтрализуя заряд и позволяя процессу продолжаться.
Как они взаимодействуют в различных ячейках
Конкретный заряд анода и катода зависит от того, генерирует ячейка электричество или потребляет его.
В гальванических (вольтовых) ячейках
Эти ячейки, такие как обычные батареи, преобразуют химическую энергию в электрическую посредством самопроизвольной реакции.
- Анод отрицательный, поскольку он является источником электронов для внешней цепи.
- Катод положительный, поскольку именно сюда электроны возвращаются в ячейку.
В электролитических ячейках
Эти ячейки используют внешнюю электрическую энергию для проведения несамопроизвольной реакции, например, при гальванопокрытии или электролизе воды.
- Анод положительный, поскольку он подключен к положительному полюсу внешнего источника питания, чтобы отводить электроны.
- Катод отрицательный, поскольку он подключен к отрицательному полюсу, чтобы принудительно подавать на него электроны.
Общие заблуждения и нюансы
Понимание основных определений — это первый шаг. Истинное понимание достигается при распознавании нюансов.
Материал электрода имеет решающее значение
Электрод не всегда является просто инертным проводником. Во многих батареях сам материал электрода активно участвует в химической реакции, например, цинковый корпус щелочной батареи действует как анод.
Функциональные типы электродов
В аналитической химии и сенсорных приложениях электродам присваиваются более конкретные названия в зависимости от их функции.
- Рабочий электрод — это место, где происходит интересующая химическая реакция.
- Электрод сравнения обеспечивает стабильный, постоянный потенциал для измерения.
- Вспомогательный электрод замыкает цепь, пропуская ток к рабочему электроду.
Как сделать правильное различие для вашей цели
Чтобы применить эти знания, сосредоточьтесь на фундаментальной роли, которую играет каждый компонент в вашем конкретном контексте.
- Если ваше основное внимание уделяется основам химии батарей: Рассматривайте электрод как место получения/потери электронов (анод/катод), а электролит — как необходимый ионный переносчик, который поддерживает работу батареи.
- Если ваше основное внимание уделяется проведению электролиза: Помните, что полярность (+/-) электродов обратна по сравнению с батареей, но их фундаментальные химические роли (анод = окисление, катод = восстановление) остаются абсолютно теми же.
- Если ваше основное внимание уделяется созданию электрохимических датчиков: Вы должны различать рабочий электрод (где происходит событие), электрод сравнения (для стабильного измерения) и вспомогательный электрод (для замыкания цепи).
В конечном счете, электрод и электролит — это два различных, но неразделимых компонента, которые составляют основу всей электрохимической технологии.
Сводная таблица:
| Компонент | Роль в электрохимической ячейке | Аналогия |
|---|---|---|
| Электрод | Твердый проводник, где происходит перенос электронов (окисление/восстановление). | Въезды/съезды для электронов во внешнюю цепь. |
| Электролит | Среда (жидкость/гель), которая позволяет ионам двигаться для поддержания заряда. | Магистраль для заряженных ионов внутри ячейки. |
| Анод | Электрод, где происходит окисление (потеря электронов). | Источник электронов (гальванический) или сток электронов (электролитический). |
| Катод | Электрод, где происходит восстановление (приобретение электронов). | Пункт назначения электронов (гальванический) или источник электронов (электролитический). |
Готовы обеспечить точность ваших исследований с помощью прецизионного электрохимического оборудования?
Понимание основ — это первый шаг. Применение этих знаний с правильными инструментами движет открытиями. Независимо от того, разрабатываете ли вы новые материалы для батарей, проводите точный электролиз или создаете чувствительные датчики, KINTEK предоставляет высококачественное лабораторное оборудование и расходные материалы, которые вам необходимы.
Мы специализируемся на удовлетворении точных потребностей лабораторий. Позвольте нам помочь вам выбрать идеальные электрохимические ячейки, электроды и электролиты для обеспечения точных и надежных результатов для вашего конкретного применения.
Свяжитесь с KINTEL сегодня, чтобы обсудить требования вашего проекта и узнать, как наши решения могут расширить возможности вашей лаборатории!
Визуальное руководство
Связанные товары
- Электрохимическая ячейка для оценки покрытий
- Двухслойная оптическая электролитическая электрохимическая ячейка H-типа с водяной баней
- Электрохимическая ячейка с пятью портами
- Кварцевая электрохимическая ячейка для электрохимических экспериментов
- Настраиваемые испытательные ячейки типа Swagelok для передовых исследований батарей и электрохимического анализа
Люди также спрашивают
- Каковы три основных компонента электролитической ячейки? Ключевые элементы химического синтеза
- Что такое электрохимическое осаждение в нанотехнологиях? Низкозатратный метод создания наноструктур
- Почему для сплава Inconel 625 необходимы система электролитического полирования и специальные электролиты? Экспертный анализ
- Какова необходимость использования YSZ в качестве твердого электролита в SOEC? Разблокируйте высокоэффективный электролиз пара
- Каких практик следует избегать при очистке электролитической ячейки? Предотвращение повреждений и обеспечение безопасности в лаборатории
- Каковы материальные свойства корпуса акриловой электролитической ячейки? | Прозрачность, безопасность и химическая стойкость
- Какие существуют варианты объема и типы корпусов электролитических ячеек? Найдите идеальный вариант для вашего эксперимента
- Каковы преимущества использования электрохимической ячейки из ПТФЭ в исследованиях актинидов? Обеспечение точных данных о коррозии



















