По сути, электролиз — это процесс использования электрической энергии для проведения химической реакции, которая не произошла бы сама по себе. Внешний источник питания прикладывает напряжение к двум электродам, погруженным в проводящий раствор или расплавленную соль, называемый электролитом. Эта приложенная энергия заставляет ионы мигрировать к электродам с противоположным зарядом, где они подвергаются разложению посредством реакций окисления и восстановления.
Электролитическая ячейка — это двигатель для обращения химических реакций. При подаче внешнего питания она заставляет электроны течь против их естественной тенденции, заставляя стабильные химические соединения распадаться на составляющие их элементы.

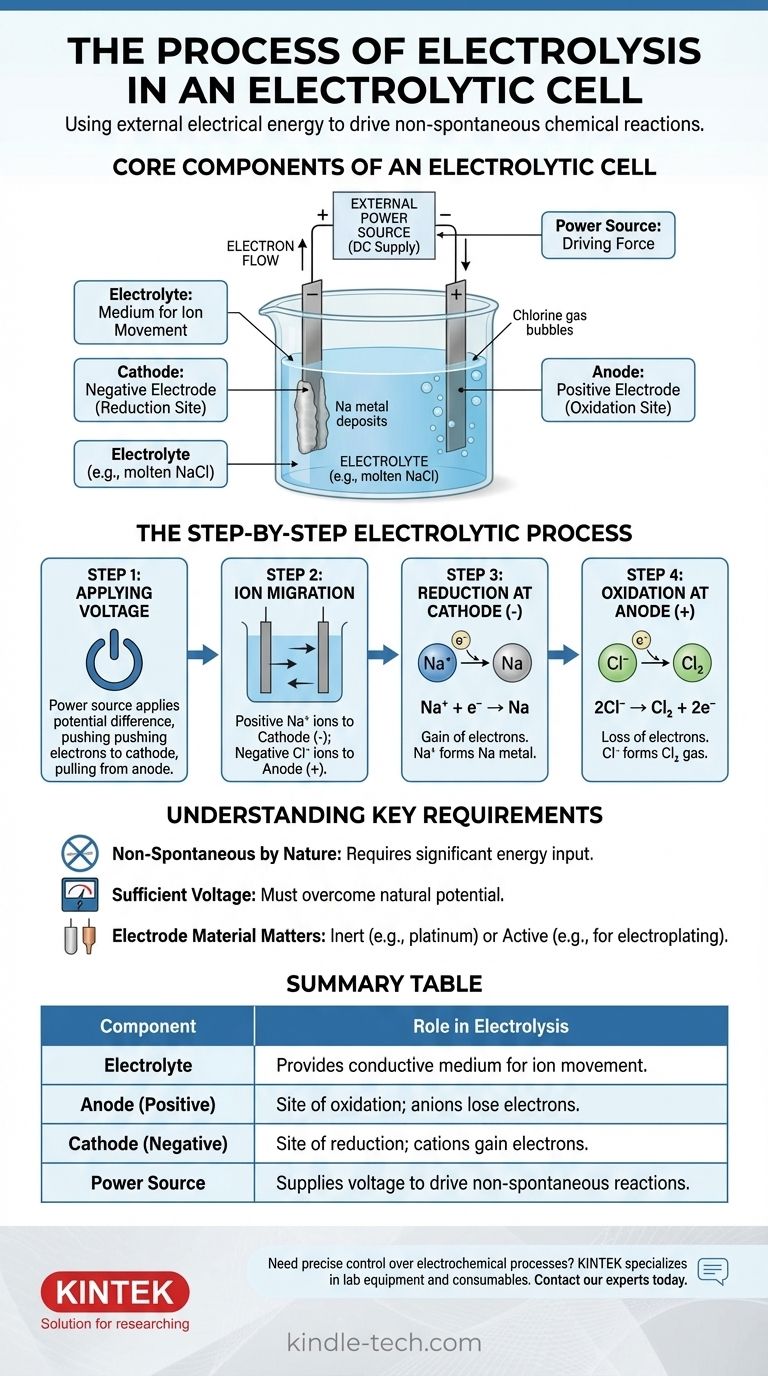
Основные компоненты электролитической ячейки
Чтобы понять процесс, вы должны сначала понять функцию каждой части. Система представляет собой тщательно упорядоченное взаимодействие трех ключевых компонентов.
Электролит: среда для движения ионов
Электролит — это вещество, содержащее свободно движущиеся ионы, что делает его электропроводным. Обычно это расплавленное ионное соединение, такое как хлорид натрия (NaCl), или водный раствор, содержащий растворенные ионы.
Единственная цель электролита — обеспечить среду, через которую заряженные ионы могут перемещаться между электродами.
Электроды: анод и катод
Электроды — это проводящие материалы (часто металлы или графит), погруженные в электролит. Они служат физическим интерфейсом, где электрическая цепь соприкасается с химическим раствором.
В электролитической ячейке полярность определяется внешним источником питания:
- Анод — это положительный электрод.
- Катод — это отрицательный электрод.
Внешний источник питания: движущая сила
Обычно это батарея или источник постоянного тока. Его задача — создать разность потенциалов между электродами, заставляя электроны двигаться в направлении, которое они не выбрали бы самопроизвольно.
Это внешнее напряжение является «насосом», который приводит в движение всю несамопроизвольную реакцию, преодолевая естественную химическую стабильность электролита.
Пошаговый процесс электролиза
Процесс разворачивается в точной последовательности после активации источника питания. Мы можем проиллюстрировать это на примере расплавленного хлорида натрия (NaCl).
Шаг 1: Приложение напряжения
Прикладывается внешнее напряжение. Источник питания выталкивает электроны к одному электроду, делая его отрицательно заряженным (катодом), и оттягивает электроны от другого, делая его положительно заряженным (анодом).
Шаг 2: Миграция ионов
В расплавленном электролите NaCl натрий существует в виде положительных ионов (катионов, Na⁺), а хлор — в виде отрицательных ионов (анионов, Cl⁻).
Противоположности притягиваются: положительные катионы Na⁺ притягиваются к отрицательному катоду, в то время как отрицательные анионы Cl⁻ притягиваются к положительному аноду.
Шаг 3: Восстановление на катоде (отрицательный электрод)
Когда катионы Na⁺ достигают отрицательно заряженного катода, они каждый получают электрон, поставляемый источником питания. Это реакция восстановления (приобретение электронов).
Ионы Na⁺ восстанавливаются с образованием нейтрального металлического натрия (Na), который осаждается на катоде.
Шаг 4: Окисление на аноде (положительный электрод)
Одновременно, когда анионы Cl⁻ достигают положительно заряженного анода, они каждый отдают электрон электроду. Эта потеря электронов является реакцией окисления.
Ионы Cl⁻ окисляются с образованием нейтральных атомов хлора, которые соединяются, образуя газообразный хлор (Cl₂), который вырывается из анода. Высвобожденные электроны проходят через внешнюю цепь обратно к источнику питания, замыкая цепь.
Понимание ключевых требований
Электролиз является мощным, но работает при определенных ограничениях. Игнорирование этих ограничений может привести к неудачным экспериментам или неправильному пониманию результатов.
По своей природе несамопроизволен
Основной принцип заключается в том, что электролиз приводит в действие несамопроизвольную реакцию. Например, разложение соли на металлический натрий и газообразный хлор требует значительного притока энергии. Без внешнего напряжения ничего бы не произошло.
Необходимость достаточного напряжения
Внешний источник питания должен подавать напряжение, достаточно высокое, чтобы преодолеть естественный потенциал химической реакции. Если напряжение слишком низкое, его будет недостаточно, чтобы заставить ионы мигрировать и передавать электроны, и реакция не пойдет.
Материал электрода имеет значение
Для простого разложения используются инертные электроды (например, платина или углерод). Эти материалы облегчают передачу электронов, не участвуя в самой реакции. В других применениях, таких как гальванотехника, анод может быть «активным» электродом, предназначенным для окисления и растворения в электролите.
Применение этого к общим примерам
Принципы электролиза универсальны, но конкретные продукты полностью зависят от используемого электролита.
- Если ваша цель — получение чистых металлов: Используйте расплавленную соль этого металла в качестве электролита. Чистый металл будет восстановлен и осажден на катоде, как это видно при промышленном производстве натрия и алюминия.
- Если ваша цель — разложение воды: Используйте воду с небольшим количеством кислоты или соли для повышения проводимости. Этот процесс приведет к образованию газообразного водорода (H₂) на катоде и газообразного кислорода (O₂) на аноде.
- Если ваша цель — гальваническое покрытие объекта: Объект, который нужно покрыть, устанавливается в качестве катода. Ионы металла из раствора электролита восстанавливаются на поверхности объекта, образуя тонкое, равномерное металлическое покрытие.
Контролируя поток электронов, мы можем напрямую контролировать и обращать химические процессы, что является фундаментальной способностью, лежащей в основе большей части современной промышленности.
Сводная таблица:
| Компонент | Роль в электролизе |
|---|---|
| Электролит | Обеспечивает проводящую среду для движения ионов (например, расплавленный NaCl). |
| Анод (положительный) | Место окисления; анионы теряют электроны (например, Cl⁻ → Cl₂ газ). |
| Катод (отрицательный) | Место восстановления; катионы приобретают электроны (например, Na⁺ → Na металл). |
| Источник питания | Подает напряжение для проведения несамопроизвольных реакций. |
Нужен точный контроль над электрохимическими процессами? KINTEK специализируется на лабораторном оборудовании и расходных материалах для электролиза, гальванотехники и синтеза материалов. Наши надежные источники питания, электроды и растворы электролитов помогают добиться стабильных результатов — будь то разложение соединений, рафинирование металлов или нанесение покрытий. Свяжитесь с нашими экспертами сегодня, чтобы обсудить конкретные потребности вашей лаборатории!
Визуальное руководство
Связанные товары
- Кварцевая электрохимическая ячейка для электрохимических экспериментов
- Двухслойная оптическая электролитическая электрохимическая ячейка H-типа с водяной баней
- Электрохимическая ячейка с газодиффузионным электролизом и ячейка для реакции с протоком жидкости
- Настраиваемая проточная ячейка для снижения CO2 для исследований NRR, ORR и CO2RR
- Корпус литий-воздушной батареи для лабораторных применений
Люди также спрашивают
- Каковы рекомендуемые процедуры после эксперимента для очистки и хранения тонкослойной спектроэлектрохимической ячейки?
- Каковы конструктивные особенности специализированной ячейки для визуализации? Раскройте возможности анализа батарей в оперантном режиме
- Каковы основные преимущества трехэлектродной электролитической ячейки для исследований кинетики окисления этанола?
- Какие меры предосторожности необходимы при проведении эксперимента по электролизу? Руководство по управлению химическими, электрическими и физическими опасностями
- Какие меры предосторожности следует соблюдать при обращении и использовании полностью кварцевой электролитической ячейки? Обеспечьте безопасную, точную и долговечную работу
- Как электрохимические травящие устройства используются для характеристики дуплексных нержавеющих сталей? Мастер анализа микроструктуры
- Какую роль играет электрохимическая ячейка в анодном осаждении тонких слоев ZIF-8? Достижение точности в нанесении покрытий MOF
- Как функционирует трехэлектродная электрохимическая ячейка при тестировании PEC? Оптимизация анализа фотоанода из MoS2



















