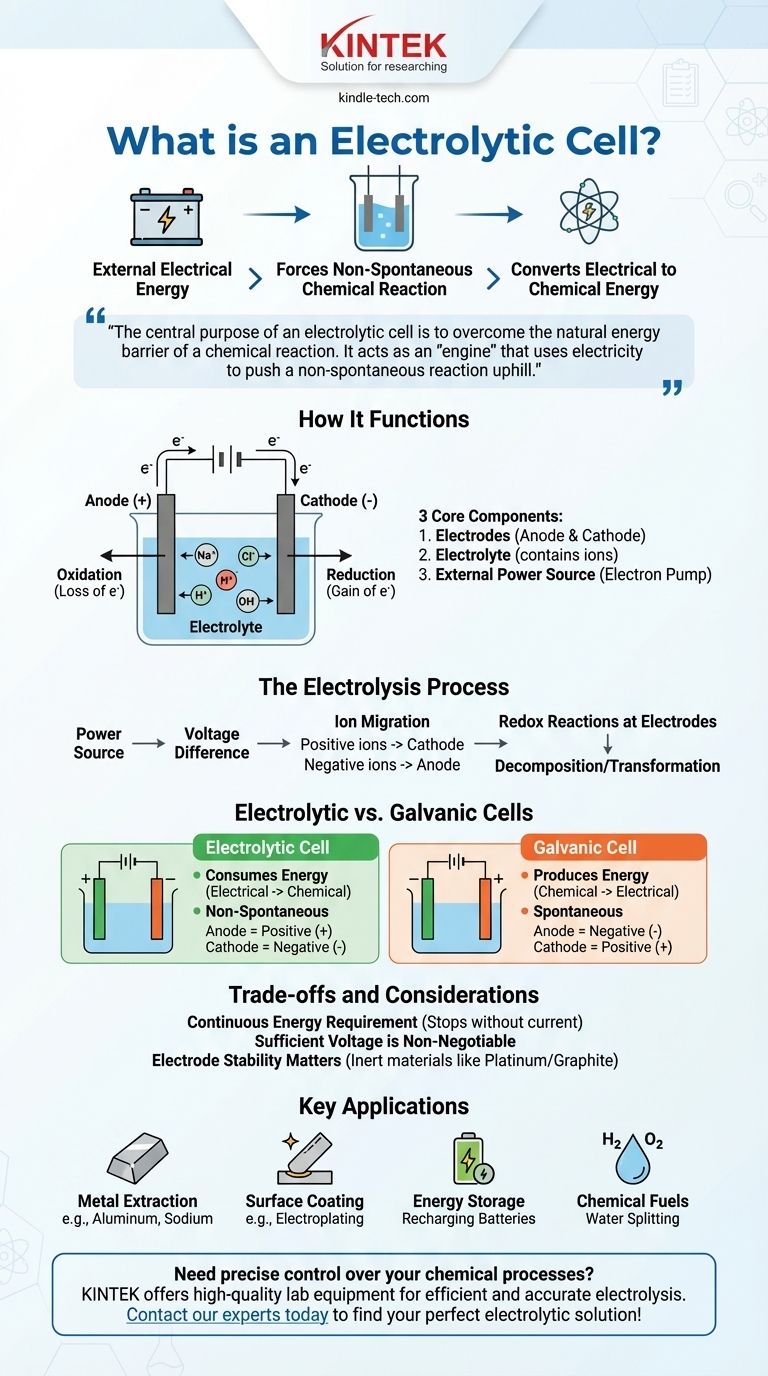
По сути, электролитическая ячейка — это устройство, которое использует электрическую энергию от внешнего источника, такого как батарея, для принудительного проведения химической реакции, которая не произошла бы сама по себе. Этот процесс, известный как электролиз, преобразует электрическую энергию в запасенную химическую энергию путем разложения соединений, таких как вода или расплавленные соли.
Основное назначение электролитической ячейки — преодолеть естественный энергетический барьер химической реакции. Она действует как «двигатель», который использует электричество для продвижения несамопроизвольной реакции «в гору», выполняя такие задачи, как разделение элементов или зарядка аккумулятора.

Как функционирует электролитическая ячейка
Чтобы понять электролитическую ячейку, мы должны рассмотреть ее основные части и процесс, который они обеспечивают. Вся система предназначена для контроля потока электронов и ионов для осуществления определенного химического изменения.
Три основных компонента
Электролитическая ячейка состоит из трех основных частей.
-
Электроды (анод и катод): Это два металлических или электронных проводника, которые служат местами для химической реакции. Анод — это положительный электрод, где происходит окисление (потеря электронов), а катод — это отрицательный электрод, где происходит восстановление (приобретение электронов).
-
Электролит: Это вещество, обычно жидкий раствор или расплавленная соль, которое содержит свободно движущиеся ионы. Электролит позволяет заряду течь между двумя электродами, замыкая электрическую цепь.
-
Внешний источник питания: Это важный компонент, такой как батарея или источник постоянного тока. Он действует как «электронный насос», оттягивая электроны от анода и толкая их к катоду.
Процесс электролиза
Источник питания создает разность напряжений между электродами.
Это заставляет ионы в электролите мигрировать. Положительно заряженные ионы движутся к отрицательному катоду, а отрицательно заряженные ионы движутся к положительному аноду.
На электродах происходят окислительно-восстановительные (перенос заряда) реакции. На аноде вещества теряют электроны, а на катоде вещества приобретают электроны, что приводит к разложению или трансформации компонентов электролита.
Критическое различие: электролитические и гальванические элементы
Часто возникает путаница между электролитической ячейкой и ее аналогом, гальванической (или вольтовой) ячейкой, которую мы обычно представляем как стандартную батарею.
Преобразование энергии
Электролитическая ячейка потребляет энергию. Она преобразует электрическую энергию в химическую энергию.
Гальваническая ячейка производит энергию. Она преобразует запасенную химическую энергию в электрическую энергию.
Самопроизвольность реакции
Реакция в электролитической ячейке является несамопроизвольной. Для ее протекания требуется внешний ввод энергии.
Реакция в гальванической ячейке является самопроизвольной. Она происходит естественным образом, выделяя энергию в процессе.
Полярность электродов
В электролитической ячейке анод положительный, а катод отрицательный. Это потому, что внешний источник питания диктует заряд.
В гальванической ячейке анод отрицательный, а катод положительный. Самопроизвольная химическая реакция сама определяет заряд.
Понимание компромиссов и соображений
Хотя электролитические ячейки мощны, они работают в определенных ограничениях, которые важно учитывать.
Непрерывное потребление энергии
Основной характеристикой электролитической ячейки является ее зависимость от внешнего источника питания. Процесс электролиза останавливается в тот момент, когда электрический ток отключается.
Достаточное напряжение является обязательным
Приложенное внешнее напряжение должно быть достаточно высоким, чтобы преодолеть естественное сопротивление несамопроизвольной реакции. Если напряжение слишком низкое, химических изменений не произойдет.
Стабильность электродов имеет значение
Сами электроды должны быть тщательно подобраны. Во многих процессах они изготавливаются из инертных материалов, таких как платина или графит, которые способствуют реакции, не расходуясь. В других случаях материал электрода намеренно выбирается для участия в реакции, как это видно в некоторых типах очистки.
Ключевые применения электролитических ячеек
Способность принудительно проводить химические реакции придает электролитическим ячейкам центральную роль в промышленности и технологиях.
- Если ваша основная цель — производство чистых элементов: Электролиз используется для извлечения металлов, таких как алюминий из его руды (боксита), или для производства натрия и газообразного хлора из расплавленного хлорида натрия.
- Если ваша основная цель — поверхностное покрытие: Процесс гальванопластики использует электролитическую ячейку для нанесения тонкого слоя одного металла (например, хрома или золота) на другой для защиты или украшения.
- Если ваша основная цель — накопление энергии: Зарядка аккумулятора включает его работу в качестве электролитической ячейки. Внешнее зарядное устройство возвращает ионы в их исходное состояние, сохраняя энергию для последующего использования.
- Если ваша основная цель — создание химического топлива: Электролитические ячейки могут расщеплять воду (H₂O) на газообразный водород и газообразный кислород, при этом водород служит чистым источником топлива.
Применяя электрическую энергию с точностью, электролитическая ячейка дает нам прямой контроль над химическими превращениями.
Сводная таблица:
| Характеристика | Электролитическая ячейка | Гальваническая ячейка (батарея) |
|---|---|---|
| Преобразование энергии | Преобразует электрическую энергию в химическую энергию | Преобразует химическую энергию в электрическую энергию |
| Тип реакции | Несамопроизвольная (требует внешнего питания) | Самопроизвольная (происходит естественным образом) |
| Заряд анода | Положительный | Отрицательный |
| Основная функция | Проведение желаемых химических реакций (например, гальванопластика) | Генерация электричества |
Нужен точный контроль над вашими химическими процессами? Высококачественное лабораторное оборудование KINTEK, включая надежные источники питания и долговечные электроды, необходимо для эффективного и точного электролиза. Независимо от того, является ли ваше применение гальванопластикой, очисткой металлов или исследованиями в области хранения энергии, наши расходные материалы и приборы разработаны для превосходной производительности. Свяжитесь с нашими экспертами сегодня, чтобы найти идеальное электролитическое решение для нужд вашей лаборатории!
Визуальное руководство
Связанные товары
- Электрохимическая ячейка с пятью портами
- Электролитическая ячейка H-типа Тройная электрохимическая ячейка
- Электрохимическая ячейка для оценки покрытий
- Двухслойная оптическая электролитическая электрохимическая ячейка H-типа с водяной баней
- Двухслойная пятипортовая электрохимическая ячейка с водяной баней
Люди также спрашивают
- Каков надлежащий способ обращения с пятипортовой электролитической ячейкой с водяной баней? Обеспечение точных и безопасных электрохимических экспериментов
- Каковы правильные процедуры хранения многофункциональной электролитической ячейки? Защитите свои инвестиции и обеспечьте точность данных
- Какую общую меру предосторожности следует соблюдать при работе с электролитической ячейкой? Обеспечьте безопасность и точность лабораторных результатов
- Каковы стандартные компоненты пятипортовой электролитической ячейки с водяной баней? Освойте прецизионный прибор для электрохимического анализа
- Как следует обслуживать корпус электролитической ячейки для обеспечения долговечности? Продлите срок службы вашего оборудования



















