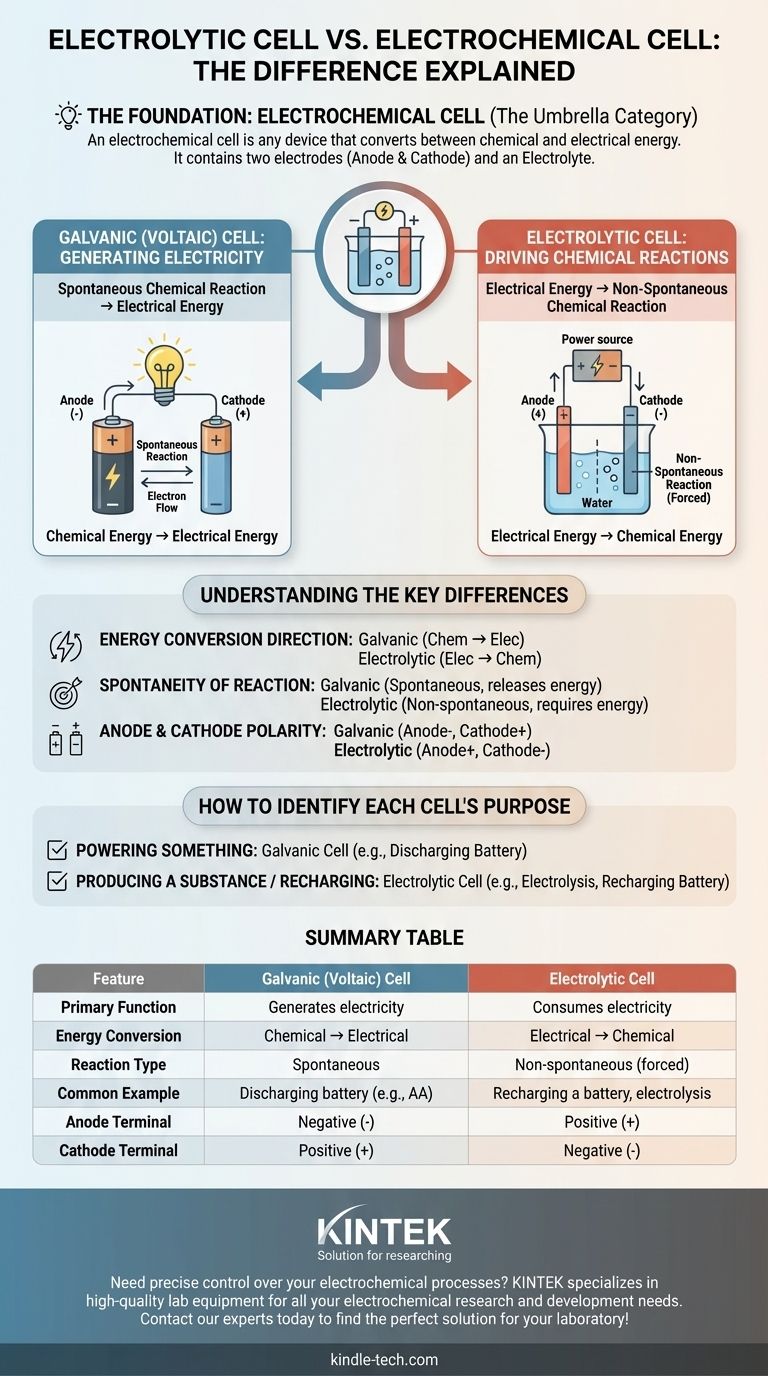
Основной источник путаницы заключается в том, что электролитическая ячейка не является отдельным понятием от электрохимической ячейки — это один из двух основных типов электрохимических ячеек. Электрохимическая ячейка — это широкая категория для любого устройства, которое преобразует химическую и электрическую энергию. Настоящее различие заключается между гальваническими (вольтовскими) ячейками, которые генерируют электричество за счет химических реакций, и электролитическими ячейками, которые используют электричество для инициирования химических реакций.
Термин электрохимическая ячейка является зонтичной категорией. Два конкретных типа под этой категорией — это гальванические ячейки (которые создают электричество) и электролитические ячейки (которые потребляют электричество). Их фундаментальное различие заключается в направлении преобразования энергии.

Основа: Что такое электрохимическая ячейка?
Основные компоненты
Электрохимическая ячейка — это любое устройство, содержащее два электрода (анод и катод) и электролит. Эти компоненты работают вместе, чтобы облегчить перенос электронов, либо создавая, либо потребляя электрический ток.
Общая цель
Единственная цель электрохимической ячейки — служить мостом между химической и электрической энергией. Направление этого преобразования энергии определяет конкретный тип ячейки.
Два фундаментальных типа преобразования
Гальванические (вольтовские) ячейки: Генерация электричества
Гальваническая ячейка, также известная как вольтовская ячейка, использует самопроизвольную химическую реакцию для выработки электрической энергии.
Представьте себе стандартную батарейку типа АА. Химические материалы внутри нее реагируют естественным образом, высвобождая энергию в виде электрического тока, который может питать устройство. Это гальваническая ячейка в действии.
Электролитические ячейки: Проведение химических реакций
Электролитическая ячейка делает прямо противоположное. Она использует внешний источник электрической энергии (например, блок питания), чтобы заставить произойти несамопроизвольную химическую реакцию.
Распространенным примером является электролиз, например, расщепление воды на водород и кислород. Эта реакция не происходит сама по себе; она требует постоянного подвода электричества, что и является функцией электролитической ячейки. Зарядка аккумулятора — еще один пример этого процесса.
Понимание ключевых различий
Направление преобразования энергии
Это самое важное различие. Гальваническая ячейка преобразует запасенную химическую энергию в электрическую энергию. Электролитическая ячейка преобразует поставляемую электрическую энергию в химическую энергию.
Самопроизвольность реакции
Химическая реакция в гальванической ячейке является самопроизвольной — она протекает естественным образом и выделяет энергию.
Реакция в электролитической ячейке является несамопроизвольной — она требует постоянного подвода внешней энергии для протекания.
Полярность анода и катода
Это распространенный источник путаницы, но он логически следует из потока энергии.
В гальванической ячейке (разряжающийся аккумулятор) анод является источником электронов, что делает его отрицательным полюсом, а катод — положительным полюсом.
В электролитической ячейке (заряжающийся аккумулятор) внешний источник питания меняет направление потока. Анод — это место, где все еще происходит окисление, но он вынужден быть положительным полюсом, а катод — отрицательным полюсом.
Как определить назначение каждой ячейки
Используйте основную функцию ячейки в качестве ориентира, чтобы легко различать два типа.
- Если основная цель — питать что-либо: Вы используете гальваническую (вольтовскую) ячейку, поскольку самопроизвольная химическая реакция производит электричество.
- Если основная цель — получить вещество или зарядить аккумулятор: Вы используете электролитическую ячейку, поскольку электричество потребляется для принудительного проведения химической реакции.
В конечном счете, обе являются просто двумя сторонами одной и той же электрохимической монеты, определяемыми тем, генерируют они электрическую энергию или потребляют ее.
Сводная таблица:
| Характеристика | Гальваническая (вольтовская) ячейка | Электролитическая ячейка |
|---|---|---|
| Основная функция | Генерирует электричество | Потребляет электричество |
| Преобразование энергии | Химическая → Электрическая | Электрическая → Химическая |
| Тип реакции | Самопроизвольная | Несамопроизвольная (принудительная) |
| Распространенный пример | Разряжающийся аккумулятор (например, АА) | Зарядка аккумулятора, электролиз |
| Полюс анода | Отрицательный (-) | Положительный (+) |
| Полюс катода | Положительный (+) | Отрицательный (-) |
Нужен точный контроль над вашими электрохимическими процессами? KINTEK специализируется на высококачественном лабораторном оборудовании для всех ваших нужд в электрохимических исследованиях и разработках. Независимо от того, разрабатываете ли вы новые аккумуляторные технологии или синтезируете материалы методом электролиза, наши надежные приборы обеспечивают точные и воспроизводимые результаты. Свяжитесь с нашими экспертами сегодня, чтобы найти идеальное решение для вашей лаборатории!
Визуальное руководство
Связанные товары
- Двухслойная оптическая электролитическая электрохимическая ячейка H-типа с водяной баней
- Электрохимическая ячейка для оценки покрытий
- Кварцевая электрохимическая ячейка для электрохимических экспериментов
- Электролитическая ячейка H-типа Тройная электрохимическая ячейка
- Электрохимическая ячейка из ПТФЭ, коррозионностойкая, герметичная и негерметичная
Люди также спрашивают
- Как следует хранить электролитическую ячейку H-типа, когда она не используется? Руководство эксперта по хранению и обслуживанию
- Каковы ключевые особенности двухслойной электролитической ячейки с водяной баней? Обеспечьте точный контроль температуры для ваших экспериментов
- Какова общая структура электролитической ячейки с оптической водяной баней H-типа? Прецизионная конструкция для контролируемых экспериментов
- Какие оптические особенности имеет электрохимическая ячейка H-типа? Прецизионные кварцевые окна для фотоэлектрохимии
- Каково назначение двухслойной конструкции электролитической ячейки H-типа? Обеспечение точного контроля температуры



















