Неводный электрод ионов серебра — это узкоспециализированный электрод сравнения, разработанный специально для электрохимических измерений в органических растворителях. Его отличительной особенностью является настраиваемая пользователем конструкция; он поставляется пустым и требует от пользователя приготовления и добавления раствора для заполнения. Это делает его гибким, но требовательным инструментом, который обеспечивает стабильный потенциал в пределах одного эксперимента, а не универсальный, абсолютный потенциал, как его водные аналоги.
Ключевой вывод заключается в том, что неводный электрод ионов серебра функционирует как квазиэлектрод сравнения (QRE). Его потенциал не фиксирован, а зависит от конкретного раствора для заполнения, который вы приготовили. Чтобы результаты были значимыми и сопоставимыми, вы должны калибровать его потенциал во время каждого эксперимента с использованием внутреннего стандарта, такого как ферроцен.

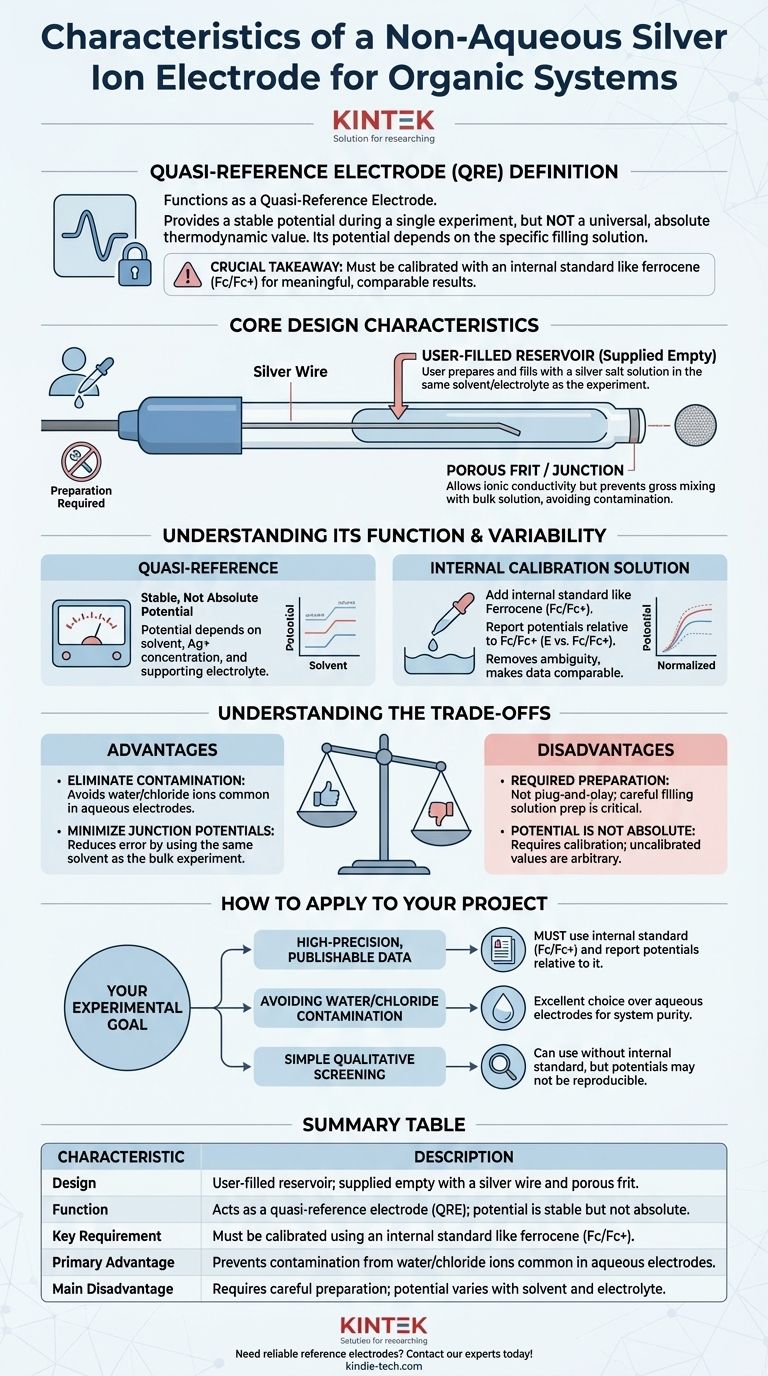
Основные конструктивные характеристики
Уникальная физическая и химическая природа этого электрода диктует, как с ним следует обращаться и как его использовать для обеспечения надежных измерений.
Резервуар, заполняемый пользователем
Наиболее заметной особенностью является то, что электрод поставляется пустым. Он состоит из серебряной проволоки, заключенной в стеклянный или полимерный корпус, который вы должны заполнить соответствующим раствором. Это преднамеренное конструктивное решение, а не мера экономии.
Роль раствора для заполнения
Вы создаете опорный потенциал, готовя раствор для заполнения, обычно известной концентрации соли серебра (например, нитрата серебра, AgNO₃, или трифлата серебра, AgOTf), растворенной в том же растворителе и содержащей тот же фоновый электролит, что и ваш основной эксперимент. Эта подготовка является наиболее важным шагом в правильном использовании электрода.
Изоляция от основного раствора
Наконечник электрода имеет пористую перегородку (фритту) или сочленение. Это обеспечивает ионную проводимость между внутренним раствором для заполнения и основным раствором в вашей электрохимической ячейке, что необходимо для завершения электрической цепи. Однако это предотвращает сильное смешивание двух растворов, что загрязнило бы ваш эксперимент и дестабилизировало бы опорный потенциал.
Понимание его функции как квазиэлектрода сравнения (QRE)
Термин «квазиэлектрод сравнения» идеально описывает поведение электрода ионов серебра, заполняемого пользователем, в органических системах.
Что такое QRE?
QRE обеспечивает стабильный потенциал в течение одного непрерывного эксперимента. Однако этот потенциал не основан на стандартизированном, общепринятом термодинамическом значении. Он является «квази»-потенциалом, поскольку его значение полностью зависит от состава и концентрации приготовленного вами раствора для заполнения.
Проблема изменчивости потенциала
Потенциал вашего Ag/Ag+ QRE будет различаться в зависимости от используемого растворителя, концентрации соли серебра и конкретного фонового электролита. Это означает, что потенциал «+0,5 В» в одном эксперименте не может быть напрямую сопоставлен с «+0,5 В» в другом эксперименте, если условия или раствор для заполнения были даже незначительно иными.
Решение: внутренняя калибровка
Чтобы получить значимые, воспроизводимые и пригодные для публикации данные, вы должны калибровать QRE in situ. Это делается путем добавления небольшого количества внутреннего стандарта с хорошо известным потенциалом окисления-восстановления в ваш анализируемый раствор.
В неводной электрохимии пара ферроцен/ферроцений (Fc/Fc+) является общепринятым стандартом. После вашего эксперимента вы просто сообщаете обо всех измеренных потенциалах относительно наблюдаемого потенциала пары Fc/Fc+ (E по отношению к Fc/Fc+). Эта практика устраняет неоднозначность QRE и делает ваши результаты сопоставимыми с исследованиями из любой другой лаборатории.
Понимание компромиссов
Использование неводного QRE сопряжено с четким набором преимуществ и недостатков, которые вы должны взвесить для вашего конкретного применения.
Преимущество: устранение загрязнения
Основная причина использования неводного электрода сравнения — избежать загрязнения вашей чувствительной органической системы водой или ионами хлора, которые неизбежны при использовании стандартных водных электродов, таких как Ag/AgCl или КЭ (каломель).
Преимущество: минимизация потенциалов жидкого перехода
Использование раствора для заполнения с тем же растворителем, что и в вашем основном эксперименте, значительно уменьшает потенциал жидкого перехода. Этот большой, нестабильный и неизвестный потенциал, который образуется на границе раздела двух разных растворителей (например, воды и ацетонитрила), является основным источником ошибок при использовании водных электродов в органических средах.
Недостаток: необходимость подготовки
Этот электрод не является устройством «включи и работай». Он требует тщательной подготовки раствора для заполнения. Неправильно приготовленный или загрязненный раствор приведет к нестабильному, дрейфующему потенциалу, который делает все ваше измерение недействительным.
Недостаток: потенциал не является абсолютным
Как обсуждалось, потенциал только стабилен, но не абсолютен. Невыполнение калибровки по отношению к внутреннему стандарту, такому как ферроцен, означает, что ваши значения потенциала произвольны и не могут быть надежно сопоставлены или воспроизведены.
Как применить это к вашему проекту
Правильное использование этого электрода полностью зависит от ваших экспериментальных целей.
- Если ваш основной акцент делается на высокоточных данных, пригодных для публикации: Вы должны использовать внутренний стандарт, такой как ферроцен, и сообщать обо всех потенциалах относительно пары окисления-восстановления Fc/Fc+.
- Если ваш основной акцент делается на избегании загрязнения водой/хлоридами: Этот электрод — отличный выбор по сравнению с любым водным аналогом, обеспечивающий чистоту вашей органической системы.
- Если ваш основной акцент делается на простом качественном скрининге: Вы можете использовать электрод без внутреннего стандарта, но вы должны принять тот факт, что потенциалы могут быть не идеально воспроизводимыми между экспериментами.
При правильном приготовлении и калибровке неводный электрод ионов серебра является незаменимым инструментом для надежного электрохимического анализа в органических средах.
Сводная таблица:
| Характеристика | Описание |
|---|---|
| Конструкция | Резервуар, заполняемый пользователем; поставляется пустым с серебряной проволокой и пористой перегородкой. |
| Функция | Действует как квазиэлектрод сравнения (QRE); потенциал стабилен, но не абсолютен. |
| Ключевое требование | Должен быть откалиброван с использованием внутреннего стандарта, такого как ферроцен (Fc/Fc+). |
| Основное преимущество | Предотвращает загрязнение ионами воды/хлора, распространенными в водных электродах. |
| Основной недостаток | Требует тщательной подготовки; потенциал зависит от растворителя и электролита. |
Нужны надежные электроды сравнения для вашей работы по органической электрохимии? KINTEK специализируется на высококачественном лабораторном оборудовании и расходных материалах, включая электроды, предназначенные для точных измерений без загрязнений в неводных системах. Наша продукция помогает исследователям, таким как вы, получать точные и воспроизводимые результаты. Свяжитесь с нашими экспертами сегодня, чтобы найти идеальное решение для нужд вашей лаборатории!
Визуальное руководство
Связанные товары
- Выпарительный тигель для органического вещества
- Сульфатно-медный электрод сравнения для лабораторного использования
- Платиновый вспомогательный электрод для лабораторного использования
- Вращающийся дисковый (кольцевой) электрод RRDE / совместим с PINE, японским ALS, швейцарским Metrohm, стеклоуглеродным платиновым
- Оборудование для осаждения из паровой фазы CVD Система Камерная Печь-труба PECVD с Жидкостным Газификатором Машина PECVD
Люди также спрашивают
- Испаряются ли каннабиноиды? Как сохранить потенцию и предотвратить деградацию
- Какой растворитель обычно используется в ИК-спектроскопии? Оптимизируйте подготовку образцов для получения более четких результатов
- При какой температуре происходит испарение? Раскройте секреты контроля скорости испарения
- Какие аналитические методы используются в лаборатории? Выберите правильный инструмент для нужд вашей лаборатории
- Как энергия преобразуется в биомассу? Использование солнечной энергии природы для возобновляемых источников энергии














