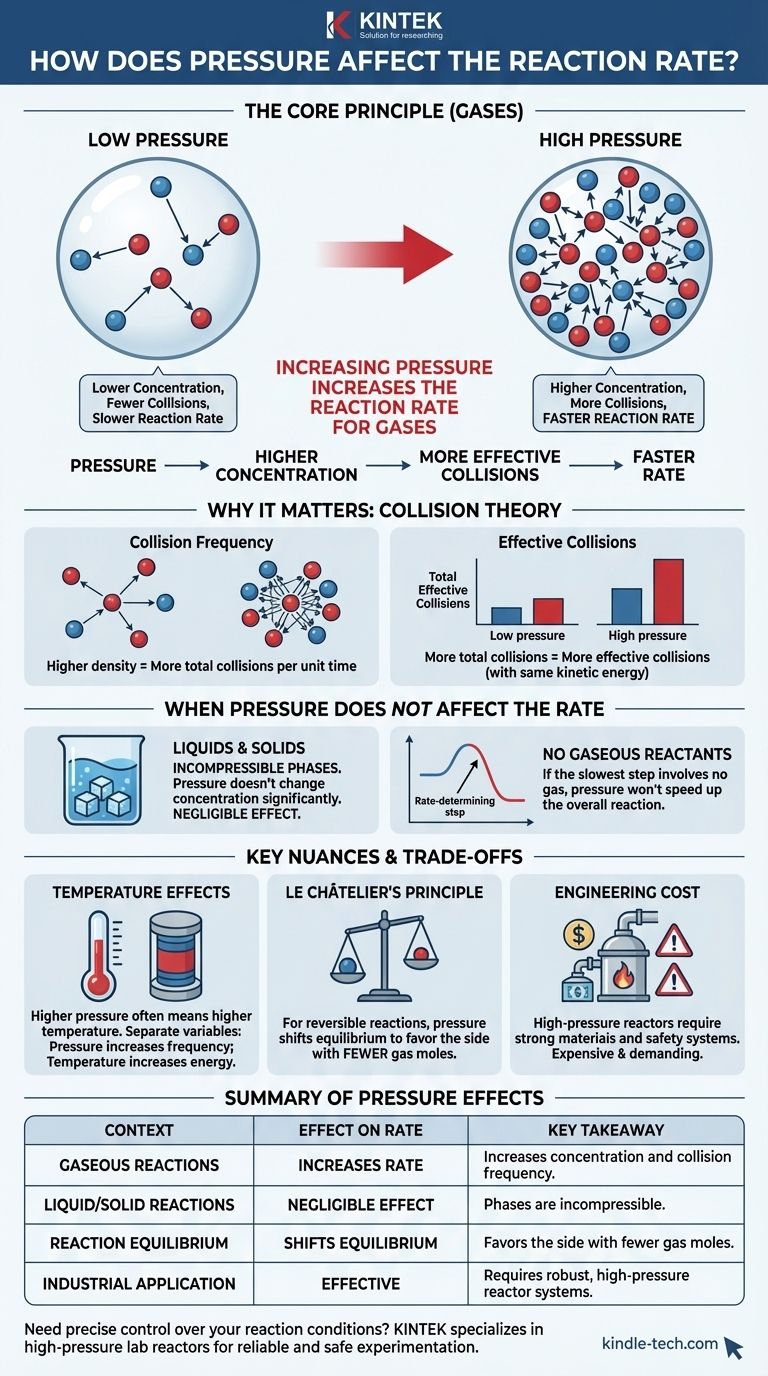
Короче говоря, увеличение давления реакции с участием газов увеличивает скорость реакции. Это происходит потому, что давление является прямой мерой концентрации газов. Сжимая молекулы газа в меньшем объеме, вы увеличиваете вероятность того, что они будут сталкиваться и реагировать друг с другом.
Основной принцип заключается в том, что для газообразных реакций давление действует как прямой рычаг на концентрацию. Более высокое давление заставляет молекулы газа сближаться, увеличивая частоту эффективных столкновений и тем самым ускоряя реакцию. Этот эффект незначителен для реакций в жидкой или твердой фазе.

Фундаментальный механизм: почему давление имеет значение
Чтобы по-настоящему понять влияние давления, нам нужно вернуться к первым принципам того, как происходят химические реакции. Все вращается вокруг концепции столкновения частиц.
Давление как мера концентрации
Для газов давление — это не абстрактная сила; это результат столкновения молекул газа со стенками их контейнера.
Закон идеального газа показывает прямую зависимость между давлением (P) и количеством молей (n) в данном объеме (V) при постоянной температуре (T). Больше молекул в том же пространстве означает большее давление. Следовательно, увеличение давления функционально эквивалентно увеличению концентрации.
Роль теории столкновений
Химические реакции происходят, когда частицы реагентов сталкиваются при соблюдении двух ключевых условий:
- Они должны обладать достаточной кинетической энергией, чтобы преодолеть энергетический барьер активации.
- Они должны сталкиваться с правильной физической ориентацией.
Столкновение, отвечающее обоим критериям, называется эффективным столкновением. Скорость реакции определяется частотой этих эффективных столкновений.
Больше давления = больше столкновений
Когда вы увеличиваете давление газообразной системы, вы заставляете то же количество молекул находиться в меньшем объеме.
Эта более высокая плотность означает, что среднее расстояние между молекулами уменьшается. Следовательно, общее количество столкновений между молекулами реагентов в единицу времени значительно увеличивается.
Влияние на "эффективные" столкновения
Хотя увеличение давления увеличивает общее количество столкновений, оно не изменяет кинетическую энергию отдельных молекул (при условии постоянной температуры).
Поэтому процент эффективных столкновений остается прежним. Однако, поскольку общее количество столкновений увеличилось, абсолютное количество эффективных столкновений в секунду также возрастает. Именно это и приводит к повышению скорости реакции.
Когда давление не влияет на скорость
Связь между давлением и скоростью реакции сильна, но она не универсальна. Крайне важно знать, когда она не применяется.
Реакции в жидкой и твердой фазах
Жидкости и твердые тела считаются несжимаемыми фазами. Приложение внешнего давления не изменяет существенно их объем или расстояние между их составляющими частицами.
Поскольку изменения давления не влияют на концентрацию реагентов в жидкостях и твердых телах, давление оказывает незначительное влияние на скорости реакций, происходящих исключительно в этих фазах.
Реакции без газообразных реагентов
Если механизм реакции включает несколько стадий, общая скорость определяется самой медленной стадией, известной как лимитирующая стадия.
Если эта лимитирующая стадия не включает газообразных реагентов, изменения внешнего давления не повлияют на общую скорость реакции.
Понимание компромиссов и нюансов
Контроль давления является распространенной промышленной стратегией, но он сопряжен с важными соображениями, выходящими за рамки простых изменений скорости.
Различие с температурными эффектами
На практике сжатие газа увеличивает его температуру. И более высокое давление, и более высокая температура увеличивают скорости реакций, но по разным причинам.
Крайне важно изолировать переменные. Давление увеличивает частоту столкновений, в то время как температура увеличивает энергию и силу этих столкновений, делая больший процент из них эффективными.
Принцип Ле Шателье и равновесие
Для обратимых реакций, достигающих состояния равновесия, давление играет двойную роль. Согласно принципу Ле Шателье, увеличение давления сместит положение равновесия в сторону реакции с меньшим количеством молей газа.
Это отдельное понятие от кинетики (скорости). Давление увеличивает скорость как прямой, так и обратной реакций, но оно может сместить окончательный баланс продуктов и реагентов.
Инженерные затраты на высокое давление
Строительство и обслуживание реакторов высокого давления технологически сложны и дороги. Материалы должны быть достаточно прочными, чтобы выдерживать напряжение, и требуются обширные системы безопасности для предотвращения катастрофических отказов. Этот экономический и безопасный компромисс является основным фактором при проектировании промышленных процессов.
Применение этого к вашей цели
Ваш подход к использованию давления полностью зависит от химической системы, с которой вы работаете, и от того, чего вы пытаетесь достичь.
- Если ваша основная цель — максимизация скорости реакции для газового процесса: Увеличение давления является прямым и эффективным методом, при условии, что вы можете управлять связанными изменениями температуры и инженерными затратами.
- Если вы изучаете химическое равновесие: Помните, что давление влияет как на скорости реакции, так и на конечное положение равновесия, благоприятствуя стороне с меньшим количеством молекул газа.
- Если ваша реакция включает только жидкости или твердые тела: Изменение внешнего давления не является жизнеспособной стратегией для контроля скорости реакции; вместо этого сосредоточьтесь на температуре, концентрации или катализаторах.
Понимая прямую связь давления с концентрацией, вы получаете мощный рычаг для контроля кинетики газообразных реакций.
Сводная таблица:
| Влияние давления на скорость реакции | Ключевой вывод |
|---|---|
| Газообразные реакции | Увеличивает скорость за счет увеличения концентрации и частоты столкновений. |
| Жидкостные/твердые реакции | Незначительный эффект; фазы несжимаемы. |
| Равновесие реакции | Смещает равновесие в сторону, благоприятствующую стороне с меньшим количеством молей газа. |
| Промышленное применение | Эффективно, но требует надежных систем реакторов высокого давления. |
Нужен точный контроль над условиями вашей реакции? KINTEK специализируется на лабораторных реакторах высокого давления и оборудовании, разработанном для надежных и безопасных экспериментов. Независимо от того, оптимизируете ли вы скорость газовой реакции или изучаете химическое равновесие, наши решения обеспечивают производительность и безопасность, которые вам нужны. Свяжитесь с нашими экспертами сегодня, чтобы найти идеальную систему для уникальных задач вашей лаборатории.
Визуальное руководство
Связанные товары
- Настраиваемые реакторы высокого давления для передовых научных и промышленных применений
- Реактор высокого давления из нержавеющей стали, лабораторный реактор высокого давления
- Миниавтоклав высокого давления из нержавеющей стали для лабораторного использования
- Лабораторная высокотемпературная вакуумная трубчатая печь
- Автоклавный реактор для гидротермального синтеза высокого давления
Люди также спрашивают
- Какова роль реакторов высокого давления в изучении окисления сплавов? Основные инструменты для исследований в сверхкритических условиях
- Какова цель использования высокотемпературного гидротермального реактора? Улучшение синтеза катода с йодом на активированном угле
- Какую роль играет автоклав в моделировании условий ВВЭР? Расширенная валидация материалов для ядерной безопасности
- Каков вклад гидротермального реактора в создание градуированных пор? Точные шаблоны для TAS
- Какова функция реактора гидротермального синтеза с постоянной температурой? Активация золы уноса угля



















