Определение и функция электрода
Оглавление
Описание электрода
Электрод — это точка, где ток входит в электролит и выходит из него. Это проводник, используемый для соединения с неметаллической частью цепи. Электроды могут быть изготовлены из таких материалов, как золото, платина, углерод, графит или металл. Они служат поверхностью для окислительно-восстановительных реакций в электрохимических ячейках. Существуют различные типы электродов, включая анод и катод.
Роль электрода в электрохимической ячейке
Электроды являются важными компонентами электрохимических ячеек. Они транспортируют электроны, образующиеся в клетке, от одной полуячейки к другой, создавая электрический заряд. Катод — это электрод, по которому ток выходит из ячейки, а анод — это электрод, куда ток входит. Электролит в ячейке действует как канал для потока электронов между катодом и анодом. Потенциал ячейки рассчитывается на основе стандартной электродной системы с опорным потенциалом 0 Вольт.

Разница между анодом и катодом
Анод и катод играют разные роли в электрохимической ячейке. В электролизерах катод заряжен отрицательно, и на этом электроде происходит реакция восстановления. Электроны движутся к катоду во время работы ячейки. С другой стороны, в электролизерах анод заряжен положительно, и на этом электроде происходит реакция окисления. Электроны покидают анод во время работы ячейки. Важно отметить, что роли анода и катода могут меняться в зависимости от направления потока электронов.
Таким образом, электроды — это проводники, используемые в электрохимических ячейках для облегчения переноса электронов. Они играют решающую роль в функционировании этих клеток и классифицируются как аноды или катоды в зависимости от типа происходящей химической реакции. Понимание роли и функций электродов имеет важное значение при изучении электрохимии.
Механика электрода
Процесс окисления и восстановления на поверхности электрода
Электрод — это металлическая поверхность, на которой между металлом и раствором, в котором он находится, устанавливается окислительно-восстановительное равновесие. Электрод может быть как анодом, так и катодом.
Анод: анод получает ток или электроны из смеси электролитов, вызывая его окисление. Когда атомы или молекулы приближаются к поверхности анода, раствор отдает электроны, что приводит к образованию положительных ионов.
Катод: катод, с другой стороны, выделяет электроны в раствор, что приводит к восстановлению.
Электрод должен быть стабильным и устойчивым к коррозии, за исключением случаев, когда электрод является расходным или используется для определенных процессов. Механическое воздействие может вызвать ухудшение качества электродов, например, выделение частиц графита, что может потребовать фильтрации. Набухание электрода также может быть проблематичным при использовании некоторых материалов.
Роль анода и катода в этих процессах
Аноды и катоды играют решающую роль в электрохимических системах, таких как батареи, топливные элементы, фотоэлектрические элементы, электролитические элементы и диоды.

Анод: Анод — это электрод, на котором происходит окисление или откуда вытекают электроны. Это клемма или проводник, через который электроны покидают гальваническую ячейку, вызывая окисление. В первичных элементах анод фиксирован и не подлежит перезарядке, а во вторичных анод может менять полярность в зависимости от направления тока.
Катод: Катодом называют электрод, на котором происходит восстановление или куда втекают электроны. Электроны попадают в ячейку на катоде и участвуют в реакциях восстановления. Подобно аноду, катод также может менять полярность во вторичных ячейках.
Коррозия электродов может быть серьезной, особенно когда в электролите колеблются потенциалы или когда в качестве анода и катода используются разные металлы. Однако ингибиторы и другие профилактические методы могут помочь уменьшить приступы электродов.
Электролиз — это процесс, происходящий в электролитических ячейках, где электрическая энергия используется для осуществления несамопроизвольных химических реакций. Окисление происходит на аноде (положительная пластина), а восстановление происходит на катоде (отрицательная пластина).
Понимание механики электрода, включая процессы окисления и восстановления, а также роли анода и катода, имеет решающее значение в различных электрохимических приложениях.
Состав материала электрода
Требования к материалу электродов
Эффективность электрохимических ячеек определяется физическими свойствами электродов. Состав материала электрода играет решающую роль в его работе. Основным требованием к материалу электрода является проводимость. В качестве электрода можно использовать любой проводящий материал, такой как металлы, полупроводники, графит или проводящие полимеры. Во многих случаях электроды состоят из комбинации материалов, каждый из которых выполняет определенную задачу. Эти материалы включают в себя:
- Активные материалы: это частицы, которые подвергаются окислению или восстановлению в электроде.
- Проводящие вещества: улучшают проводимость электрода.
- Связующие: они используются для удержания активных частиц внутри электрода.
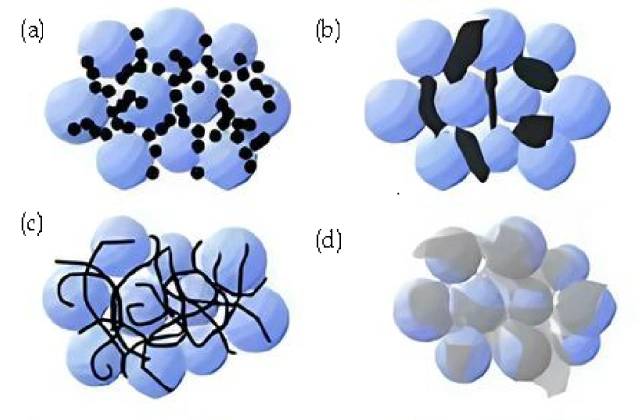
![Краткое описание проводящих агентов (a. Технический углерод, жесткие наночастицы; точечный контакт. b. Проводящий графит, жесткие микронные частицы; двухточечный контакт. c. Гибкие углеродные нанотрубки; линейный и точечный контакт d. Графит , гибкий лист; поверхностный и точечный контакт. )]()
Краткое описание проводящих агентов (a. Технический углерод, жесткие наночастицы; точечный контакт. b. Проводящий графит, жесткие микронные частицы; двухточечный контакт. c. Гибкие углеродные нанотрубки; линейный и точечный контакт d. Графит , гибкий лист; поверхностный и точечный контакт. )
Помимо проводимости, к другим важным свойствам электродов относятся удельное электросопротивление, удельная теплоемкость, электродный потенциал и твердость. Стоимость материала также является важным фактором, который следует учитывать при технологическом применении.
Примеры инертных и реактивных электродов
Электрод может быть как инертным, так и реактивным, в зависимости от его участия в окислительно-восстановительной (окислительно-восстановительной) реакции. Инертные электроды не участвуют в реакции и химически неактивны. Примеры инертных электродов включают графит (углерод), платину, золото и родий. Эти материалы используются, когда единственной целью электрода является облегчение протекания тока в гальванической ячейке.
С другой стороны, реактивные электроды активно участвуют в окислительно-восстановительной реакции. Они подвергаются окислению или восстановлению вместе с реагентами. Например, магниевый электрод является активным электродом, поскольку участвует в реакции. Выбор между инертными и реактивными электродами зависит от конкретных требований электрохимического процесса.
Роль электрода в реакции
Электрод служит платформой для протекания окислительно-восстановительной реакции. В некоторых случаях в качестве электродов используют твердые формы реагентов. Например, в электрохимической ячейке медь-серебро медь и серебро являются одновременно реагентами и электродами. Электроды-реагенты облегчают перенос электронов и ионов во время окислительно-восстановительной реакции.
Альтернативно, в реакциях, требующих инертного электрода, используется металл, не участвующий в реакции. Примером этого является платина в реакции стандартного водородного электрода (SHE). Инертный электрод пропускает ток, не мешая химической реакции.
Выбор материала электрода имеет решающее значение для достижения оптимального выхода и селективности в электрохимических процессах. Свойства материала влияют на кинетику и термодинамику переноса электронов и могут определять успех или неудачу преобразования. Такие соображения, как стоимость, стабильность и возможность использования в различных формах, также играют роль в выборе подходящего материала электрода.
Состав материала и внутренняя структура электрода являются важными факторами, определяющими его характеристики. Сочетание активных материалов, проводящих агентов и связующих в электродной суспензии повышает ее проводимость и функциональность. Затем смесь наносится на проводник, который действует как коллектор тока в электрохимической ячейке.
Таким образом, состав материала электрода, инертного или реактивного, существенно влияет на его эффективность и функциональность в электрохимических процессах. Выбор материала электрода должен основываться на конкретных требованиях применения с учетом таких факторов, как проводимость, стабильность и стоимость.
Примеры электродов
Примеры часто используемых инертных и реактивных электродов
Различают активные электроды и инертные электроды. Например, магниевый электрод обычно является активным электродом, поскольку он участвует в окислительно-восстановительной (окислительно-восстановительной) реакции. Платиновый электрод обычно является инертным электродом, поскольку не участвует в окислительно-восстановительной реакции. Инертный электрод химически инертен и присутствует только для того, чтобы ток мог течь через электрохимическую ячейку.
Примеры электродов в аналитической химии
Примерами типичных материалов, используемых для изготовления электродов в аналитической химии, являются аморфный углерод, золото и платина. Стеклянные электроды часто используются для измерения pH; в этом случае стекло химически легировано, чтобы быть селективным по отношению к ионам водорода.
Примеры электродов в батареях
Батареи содержат различные электроды, в зависимости от типа батареи.
- Свинцово-кислотные аккумуляторы основаны на свинцовых электродах.
- Угольно-цинковые аккумуляторы изготавливаются с использованием цинковых и аморфных углеродных электродов.
- Литий-полимерные батареи имеют электроды, состоящие из твердой полимерной матрицы, внутри которой ионы лития могут перемещаться и действовать как носители заряда.
![Свинцово-кислотные аккумуляторы, углеродно-цинковые аккумуляторы и литий-полимерные аккумуляторы.]()
Свинцово-кислотные аккумуляторы, углеродно-цинковые аккумуляторы и литий-полимерные аккумуляторы.
Примеры электродов в электролизе
Электрическую энергию можно использовать для превращения солей и руд в металлы.
- В процессе Холла-Эру для извлечения металлического алюминия из оксида алюминия анод и катод изготовлены из графита.
- Металлический натрий получают электролизом с использованием угольного анода и железного катода.
Инертные электроды
Металл, который не вмешивается и не участвует в каких-либо химических реакциях, называется инертным электродом. Однако он по-прежнему используется для передачи электричества путем пропускания электронов через раствор вместо обмена ионами.
Примеры инертных электродов включают графит, платину, золото и родий.
Электроды в количественном анализе
При потенциометрическом анализе индикаторный электрод реагирует на различия в активности аналита или «эффективной концентрации». Эта простота делает потенциометрию экономичным методом по сравнению с атомной спектроскопией или ионной хроматографией. Эти процедуры можно классифицировать в зависимости от контролируемых аспектов клетки.
Использование электродов
Электроды используются для подачи тока через неметаллические объекты, для их изменения различными способами и для измерения проводимости в различных целях. Вот некоторые примеры:

- Электроды для топливных элементов
- Электроды для медицинских целей, такие как ЭЭГ (для записи активности мозга), ЭКГ (запись сердечных сокращений), ЭСТ (электрическая стимуляция мозга), дефибриллятор (запись и проведение сердечной стимуляции).
- Электроды для электрофизиологических методов биомедицинских исследований
- Электроды для казни на электрическом стуле
- Электроды для гальваники
- Электроды для дуговой сварки
- Электроды для катодной защиты
- Электроды для заземления
- Электроды для химического анализа электрохимическими методами
- Наноэлектроды для высокоточных измерений в наноэлектрохимии
- Инертные электроды для электролиза (из платины)
- Мембранный электрод в сборе
- Электроды для электрошокового оружия Taser
Стандартный водородный электрод (SHE)
Определение и важность SHE
Стандартный водородный электрод (SHE) — это электрод, который ученые используют в качестве эталона для всех потенциальных реакций полуэлемента. Значение стандартного электродного потенциала равно нулю, что делает его основой для расчета потенциалов клеток с использованием различных электродов или концентраций. Наличие общего электрода сравнения, такого как SHE, имеет решающее значение для точных измерений и сравнений в электрохимических экспериментах.
Состав материала и процесс реакции ТАЭ
SHE состоит из 1,0 М раствора H+(водного раствора), содержащего квадратный кусок платинированной платины. Платина соединена с платиновым проводом, обеспечивая обмен электронами. Внутри стеклянной трубки в раствор пропускают газообразный водород, что приводит к следующей реакции:
2H+(вод) + 2e- ⇌ H2(г)
Это равновесие между ионами водорода и газообразным водородом устанавливает опорный потенциал СТЭ.

Проблемы при настройке и использовании SHE
Настройка и использование SHE может вызвать некоторые проблемы. Одной из задач является обеспечение стабильности электрода сравнения во времени и при изменении температуры. Компоненты СТЭ должны быть стабильными и обеспечивать фиксированные, воспроизводимые электродные потенциалы.
Другая проблема заключается в конструкции электрода сравнения. SHE состоит из стеклянной рубашки с небольшим входным отверстием вверху и несколькими выходными отверстиями внизу. Внутри стеклянной оболочки находится стеклянная трубка, запечатанная с обоих концов, содержащая платинированную платиновую проволоку и платинированную платиновую пластину на нижнем конце. Стеклянную рубашку и трубку погружают в сосуд, содержащий 1 М раствор HCl. Правильная конструкция этих компонентов имеет важное значение для правильного функционирования SHE.
Таким образом, стандартный водородный электрод является жизненно важным инструментом в электрохимии, служащим эталоном для измерения и сравнения электродных потенциалов. Его конструкция и использование требуют пристального внимания для обеспечения стабильности и точности экспериментальных измерений.
Трехэлектродная система
Трехэлектродная система является важным компонентом вольтамперометрии. Он состоит из трех электродов: рабочего электрода, электрода сравнения и вспомогательного электрода. Каждый электрод играет определенную роль в системе.
Описание трехэлектродной системы
Трехэлектродная система используется в электроаналитической химии для проведения вольтамперометрического анализа. Он позволяет измерять и контролировать ток в электрохимической ячейке. Система состоит из следующих электродов:
Рабочий электрод : Рабочий электрод отвечает за транспортировку электронов к веществам, присутствующим в ячейке, и обратно. Он облегчает электрохимические реакции, происходящие при вольтамперометрии.
Электрод сравнения : Электрод сравнения имеет установленный электродный потенциал. Его можно использовать в качестве полуэлемента в электрохимической ячейке. Сравнивая потенциал рабочего электрода с электродом сравнения, можно определить электродный потенциал рабочего электрода.
Вспомогательный электрод : Вспомогательный электрод гарантирует, что ток не проходит через ячейку сравнения. Он уравновешивает ток с током рабочего электрода. Вспомогательный электрод также известен как противоэлектрод.
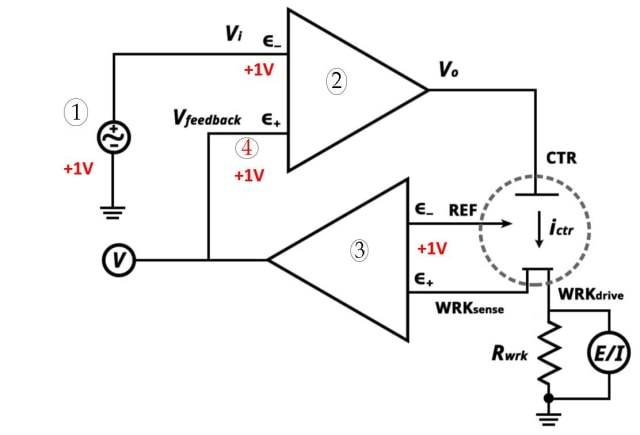
![Трехэлектродная система (1. Потенциостатическая уставка 2. Операционный усилитель с высоким коэффициентом усиления 3. Электрометр 4. Очень близко)]()
Трехэлектродная система (1. Потенциостатическая уставка 2. Операционный усилитель с высоким коэффициентом усиления 3. Электрометр 4. Очень близко)
Роль рабочего, эталонного и вспомогательного электродов.
В трехэлектродной системе каждый электрод играет определенную роль:
Рабочий электрод облегчает электрохимические реакции, транспортируя электроны к веществам в ячейке и от них.
Электрод сравнения обеспечивает известный электродный потенциал, относительно которого можно измерить потенциал рабочего электрода. Он действует как точка отсчета для определения электродного потенциала рабочего электрода.
Вспомогательный электрод, также известный как противоэлектрод, обеспечивает протекание тока через гальваническую ячейку, минуя электрод сравнения. Он уравновешивает ток с током рабочего электрода.
Трехэлектродная система имеет явные преимущества перед двухэлектродными установками. Это позволяет изолировать рабочий электрод, что позволяет точно и уверенно изучать конкретные реакции. Эта установка обычно используется в электрохимических экспериментах.
С другой стороны, двухэлектродные установки используются в тех случаях, когда важно измерение напряжения всей ячейки, например, в электрохимических энергетических устройствах, таких как батареи, топливные элементы и суперконденсаторы. Его также можно использовать, когда ожидается, что потенциал противоэлектрода будет оставаться стабильным на протяжении всего эксперимента.
В целом трехэлектродная система является важнейшим инструментом в вольтамперометрии, позволяющим точно измерять и контролировать электрохимические реакции.
Примеры электродов сравнения
Описание и принцип работы Каломельного электрода
Каломельный электрод состоит из стеклянной трубки с боковым отводом. В нижней части трубки находится чистая ртуть с впаянной в нее платиновой проволокой для электрических соединений. Над ртутью находится паста хлорной ртути (каломель). Остальная часть трубки заполнена насыщенным раствором KCl. Пистолет используется для погружения его в любой раствор, используемый для соединения каломельного электрода.

Работа: Каломельный электрод может действовать как отрицательный электрод, и возможны две реакции в зависимости от природы другого электрода, с которым он соединен. При работе в качестве отрицательного электрода происходят следующие реакции:
- 2 Hg(l) → 2 Hg+ + 2 e–
- 2 Hg+ + 2 Cl– → Hg2Cl2(тв)
Итоговая реакция окисления представляет собой образование хлорида ртути.
Преимущества каломельного электрода:
- Относительно проще в изготовлении и обслуживании по сравнению со стандартным водородным электродом (SHE).
- Состоит из твердой пасты и жидкой ртути, что делает его удобным в использовании.
- Не требует отдельного солевого мостика, так как уже содержит боковую трубку с раствором KCl.
- Потенциал существенно не меняется со временем и при небольших изменениях температуры.
Недостатки каломельного электрода:
- Компенсация потенциала необходима при измерении потенциалов полуэлементов.
- Не может использоваться для измерения потенциалов, в которых мешают ионы K+ и Cl–.
- Потенциал окисления зависит от концентрации KCl, поэтому изменения концентрации могут повлиять на потенциал электрода.
Описание и процесс изготовления электрода из хлорида серебра-серебра.
Электрод из хлорида серебра и серебра широко используется в качестве электрода сравнения из-за его доступности и меньшей токсичности по сравнению с каломельным электродом. Этот электрод состоит из твердого серебра и его осажденной соли AgCl. Его изготавливают путем покрытия проволоки из твердого серебра AgCl и погружения ее в трубку с раствором KCl и AgCl.

Работа: Электрод из хлорида серебра и серебра позволяет образовываться ионам и электронам течь в электродную систему и выходить из нее. Он может действовать как электрод сравнения в сочетании с другим электродом.
Преимущества хлоридсеребряного электрода:
- Недорогой и широко доступный
- Менее токсичен по сравнению с каломельным электродом.
- Легко настроить и воспроизвести
- Удобно и легко транспортировать
- Компактный и небольшой по размеру, требующий мало места
- Отдельный солевой мостик не требуется, так как он уже содержит боковую трубку с раствором KCl.
- Потенциал остается относительно стабильным во времени и при небольших изменениях температуры.
Электроды сравнения необходимы в электрохимическом анализе, поскольку они обеспечивают стабильный и постоянный потенциал для сенсорных измерений. Каломельный электрод и электрод из хлорида серебра и серебра — два примера, обычно используемые в водной электрохимии. Они имеют свои преимущества и недостатки, а их пригодность зависит от конкретного применения и требований.
Связанные товары
- Электрохимическая ячейка для оценки покрытий
- Электролитическая ячейка H-типа Тройная электрохимическая ячейка
- Платиновая листовая электродная система для лабораторных и промышленных применений
- Электрохимическая ячейка для электролиза плоской коррозии
- Электрод из золотого листа для электрохимии
Связанные статьи
- Понимание насыщенных каломельных эталонных электродов: Состав, применение и соображения
- Сосуд истины: почему контейнер важнее химии
- Передовые методы оценки покрытий с помощью электролитических ячеек
- Стеклянное сердце: почему хорошая наука умирает в грязных ячейках
- Парадокс прозрачности: освоение хрупкого искусства электролитических ячеек