Оглавление
Введение в электрохимические ячейки
Электрохимические ячейки лежат в основе хранения и преобразования энергии. Они используют химические реакции для выработки электричества или используют электричество для приведения в движение химических реакций. Эти элементы являются важнейшими компонентами различных электрохимических систем, включая батареи, топливные элементы и гальванические покрытия, и играют важную роль в развитии энергетических технологий, электромобилей и электрохимической инженерии.
Типы электрохимических ячеек
Электрохимические элементы - это устройства, преобразующие химическую энергию в электрическую (вольтаические элементы) или наоборот (электролитические элементы). Они состоят из двух электродов, катода и анода, погруженных в раствор электролита.
Вольтаические элементы
Вольтовы элементы, также известные как гальванические элементы, вырабатывают электричество в результате спонтанных химических реакций. В вольтовой ячейке анод - это отрицательный электрод, на котором происходит окисление, высвобождающее электроны. Эти электроны по внешней цепи поступают на катод, положительный электрод, где происходит восстановление. Самопроизвольный характер реакции приводит в движение поток электронов и генерирует электрический ток.
Электролитические ячейки
Электролитические ячейки, с другой стороны, используют электричество для запуска неспонтанных химических реакций. В электролитической ячейке катод - это отрицательный электрод, на котором происходит восстановление, а анод - положительный электрод, на котором происходит окисление. Внешний источник питания обеспечивает электрическую энергию, необходимую для того, чтобы заставить протекать несамопроизвольную реакцию.
Основные различия
Ключевые различия между вольтовыми и электролитическими ячейками следующие:
- Спонтанность: Вольтаические элементы вырабатывают электричество в результате спонтанных реакций, в то время как электролитические элементы требуют внешней энергии для приведения в действие неспонтанных реакций.
- Направление потока электронов: В вольтаических элементах электроны текут от анода к катоду по внешней цепи. В электролитических элементах электроны текут от катода к аноду через внешнюю цепь.
- Применение: Вольтаические элементы используются в батареях, солнечных батареях и других устройствах, вырабатывающих электричество. Электролитические элементы используются в гальванике, рафинировании металлов и других промышленных процессах.
Компоненты электрохимических ячеек
Электрохимические ячейки обычно состоят из следующих компонентов:
- Электроды: Катод и анод, изготовленные из проводящих материалов (например, металлов, графита).
- Электролит: Раствор или расплавленная соль, которая проводит ионы, обеспечивая протекание тока между электродами.
- Сепаратор: Пористый барьер, который предотвращает непосредственное соприкосновение электродов, но позволяет ионам проходить через него.
Дополнительная информация
- Потенциал ячейки, или напряжение, электрохимической ячейки - это мера движущей силы реакции. В вольтаических ячейках потенциал ячейки положительный, что указывает на спонтанную реакцию. В электролитических ячейках потенциал ячейки отрицательный, что свидетельствует о несамопроизвольной реакции.
- Эффективность электрохимической ячейки определяется такими факторами, как материал электродов, концентрация электролита и температура.
- Электрохимические ячейки играют важнейшую роль в различных технологических приложениях, включая хранение энергии, химический синтез и восстановление окружающей среды.
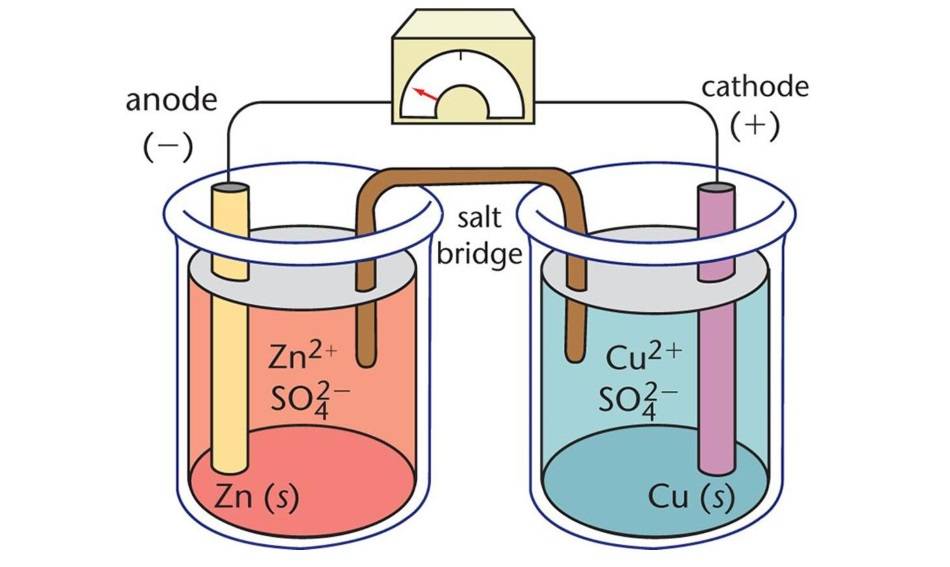
Компоненты электролитических ячеек
Электролитические ячейки, являющиеся разновидностью электрохимических ячеек, представляют собой устройства, использующие электрическую энергию для запуска неспонтанных химических реакций. Они состоят из трех основных компонентов: анода, катода и электролита.
Анод
Анод служит отрицательным электродом в электролитической ячейке. Во время электрохимической реакции анод отдает электроны во внешнюю цепь и подвергается окислению. Другими словами, анод - это место, где происходит потеря электронов и окисление.
Катод
Катод, с другой стороны, выступает в роли положительного электрода. Он получает электроны из внешней цепи и восстанавливается в ходе электрохимической реакции. Таким образом, катод - это место, где происходит захват электронов и восстановление.
Электролит
Электролит - это вещество, которое содержит подвижные ионы при растворении в растворителе или расплаве. В электролитических ячейках электролит служит средой для движения ионов между анодом и катодом, завершая электрическую цепь. К распространенным электролитам относятся водные растворы солей и расплавленные соли.
Основные отличия от гальванических элементов
Электролитические элементы отличаются от гальванических элементов по нескольким ключевым аспектам:
- Реакции в ячейках: Электролитические элементы требуют внешнего источника электрической энергии для запуска неспонтанных реакций, в то время как гальванические элементы генерируют электрическую энергию в результате спонтанных реакций.
- Поток энергии: Электролитические элементы потребляют электрическую энергию для стимулирования неспонтанных реакций, в то время как гальванические элементы преобразуют химическую энергию в электрическую.
- Заряды электродов: В электролитических элементах анод отрицательный, а катод положительный, в то время как в гальванических элементах анод положительный, а катод отрицательный.
Работа электролитической ячейки
Работа электролитической ячейки включает в себя следующие этапы:
- Внешний источник энергии (например, батарея) подключается к электродам электролитического элемента.
- Источник питания обеспечивает электрическую энергию, которая приводит в движение несамопроизвольную реакцию.
- На аноде происходит окисление, в результате чего электроны высвобождаются во внешнюю цепь.
- Электроны проходят через внешнюю цепь к катоду.
- На катоде происходит восстановление, потребляя электроны из внешней цепи.
- Ионы в электролите мигрируют для поддержания электрической нейтральности, завершая цепь.
Применение электролитических ячеек
Электролитические ячейки имеют множество практических применений, в том числе:
- Гальваника: Нанесение тонкого слоя металла на поверхность в декоративных или защитных целях.
- Электролиз воды: Получение водорода и кислорода из воды, которые используются в топливных элементах и других приложениях.
- Производство химикатов: Синтез различных химических веществ, таких как хлор, гидроксид натрия и алюминий.
- Рафинирование металлов: Очистка металлов путем удаления примесей с помощью электролиза.

Электродные потенциалы и окислительно-восстановительные реакции
Электрохимические ячейки способствуют окислительно-восстановительным (редокс) реакциям. Эти ячейки бывают двух видов: гальванические (вольтовы), в которых происходят спонтанные реакции, и электролитические, в которых протекают неспонтанные реакции.
В электрохимических ячейках реакция окисления происходит на аноде (отрицательный полюс), а реакция восстановления - на катоде (положительный полюс). В электролитических ячейках анод притягивает анионы, делая его положительным, а в гальванических ячейках анод отрицателен из-за высвобождения электронов в результате спонтанной реакции окисления.
Направление потока электронов и спонтанность окислительно-восстановительных реакций определяются электродным потенциалом, который представляет собой разность потенциалов между электродами. В качестве точки отсчета служит стандартный водородный электрод (SHE), напряжение на котором равно 0 вольт.
Потенциал клетки, который можно предсказать с помощью электродных потенциалов, дает оценку измеряемого потенциала. Чтобы рассчитать потенциал ячейки, необходимо сбалансировать уравнения полуклеточных реакций и определить разность напряжений между электродными потенциалами.
Катод и анод играют разные роли в электрохимических ячейках:
Катод:
- Положительный знак из-за потребления электронов.
- Происходит реакция восстановления
- Электроны поступают
Анод:
- Отрицательный знак из-за выделения электронов
- Происходит реакция окисления
- Электроны выходят
По традиции при обозначении электрохимической ячейки катод изображается с правой стороны, а анод - с левой.
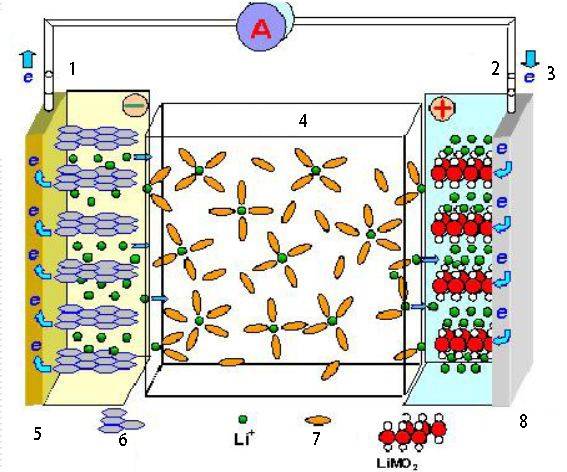
Применение электрохимических ячеек
Электрохимические ячейки находят широкое применение в различных областях, включая хранение энергии, преобразование и промышленные процессы.
Гальваника
Гальваника - это процесс, в котором используются электрохимические ячейки для нанесения тонкого слоя металла на поверхность другого металла. Этот процесс улучшает свойства основного металла, такие как коррозионная стойкость, стойкость к истиранию и износостойкость. Гальваническое покрытие широко используется в таких отраслях, как автомобилестроение, электроника и ювелирное дело, как в функциональных, так и в эстетических целях.
Батареи
Электрохимические элементы составляют основу батарей, которые являются важнейшими компонентами многочисленных электронных устройств и приборов. Батареи накапливают химическую энергию и при необходимости преобразуют ее в электрическую. Они жизненно важны для питания портативных устройств, таких как смартфоны, ноутбуки и электромобили.
Электроосаждение и электрорафинирование
Электрохимические элементы используются в процессах электровиннинга и электрорафинирования для получения и очистки металлов. Электровиннинг предполагает извлечение металлов из руд или других источников с помощью электролиза, а электрорафинирование - дальнейшую очистку металлов путем удаления примесей. Эти процессы имеют решающее значение для получения металлов высокой чистоты, таких как медь, цинк и алюминий, которые необходимы для различных промышленных применений.
Другие применения
Электрохимические ячейки находят применение и в других областях:
- Водоподготовка: Они используются в электролизе воды для получения газообразного водорода и газообразного кислорода, которые необходимы для топливных элементов и других промышленных процессов.
- Топливные элементы: Электрохимические ячейки являются основными компонентами топливных элементов, которые вырабатывают электричество в результате электрохимических реакций с участием водорода и кислорода.
- Химический синтез: Электрохимические элементы могут использоваться в процессах химического синтеза для получения различных химических веществ и материалов.
- Датчики и биосенсоры: Электрохимические ячейки используются в сенсорах и биосенсорах для обнаружения и анализа конкретных веществ на основе их электрохимических свойств.

Заключение
Электрохимические ячейкиблагодаря своей способности преобразовывать химическую энергию в электрическую и наоборот, являются незаменимыми инструментами в различных областях. Они служат основой для хранения и преобразования энергии, а также для многочисленных промышленных процессов. От батарей, питающих наши устройства, до топливных элементов, вырабатывающих чистую энергию, электрохимические элементы продолжают определять технологический прогресс. Понимание принципов их работы и применения имеет первостепенное значение для дальнейших инноваций в области энергетических технологий, устойчивых решений и электрохимической инженерии.
Связанные товары
- Электролитическая ячейка H-типа Тройная электрохимическая ячейка
- Электрохимическая ячейка с газодиффузионным электролизом и ячейка для реакции с протоком жидкости
- Электрохимическая ячейка для оценки покрытий
- Оптическая электрохимическая ячейка с боковым окном
- Кварцевая электрохимическая ячейка для электрохимических экспериментов
Связанные статьи
- Электрохимия Наука об электрохимических элементах
- Понимание электролизеров и их роли в очистке меди и гальванике
- Искусство сопротивления: почему вашей электролитической ячейке нужно пространство для дыхания
- Применение электролитических ячеек в очистке и гальванике
- Понимание кварцевых электролитических элементов: Применение, механизмы и преимущества




















