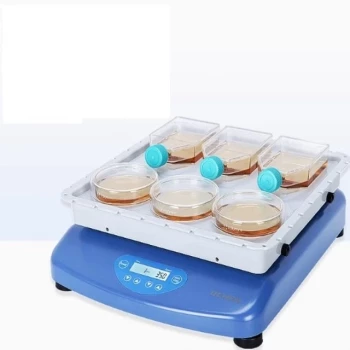
По сути, хлорид калия (KCl) используется в каломельном электроде по двум критически важным причинам. Во-первых, ион хлора (Cl⁻) является ключевым компонентом химической реакции, которая устанавливает стабильное напряжение электрода. Во-вторых, его ионы калия (K⁺) и хлора (Cl⁻) перемещаются в растворе с почти одинаковой скоростью, что является определяющей характеристикой идеального электролита солевого мостика.
Двойная функция KCl является ключом к успеху каломельного электрода. Это не просто пассивный компонент; он активно участвует в установлении опорного потенциала, одновременно предотвращая ошибки измерений, выступая в качестве высокоэффективного солевого мостика.

Двойная роль KCl в работе электрода
Выбор KCl является намеренным инженерным решением, предназначенным для создания стабильного, воспроизводимого и удобного опорного электрода. Он выполняет две отдельные, но одинаково важные функции.
Установление опорного потенциала
Напряжение каломельного электрода генерируется специфическим химическим равновесием: Hg₂Cl₂(тв) + 2e⁻ ⇌ 2Hg(ж) + 2Cl⁻(водн).
Потенциал этой реакции напрямую зависит от концентрации ионов хлора (Cl⁻) в растворе. Заполняя электрод раствором KCl известной и постоянной концентрации, устанавливается стабильный и предсказуемый опорный потенциал.
Чаще всего используется насыщенный раствор KCl. Это гарантирует, что концентрация остается постоянной, даже если часть воды испаряется, обеспечивая высокую воспроизводимость напряжения, что делает его надежным эталоном для электрохимических измерений.
Функционирование в качестве идеального солевого мостика
Раствор KCl также действует как солевой мостик, соединяя внутренние компоненты опорного электрода с измеряемым вами образцом раствора.
Эффективный солевой мостик требует, чтобы его положительные и отрицательные ионы мигрировали через раствор с почти одинаковой скоростью. Это свойство известно как эквитрансферность.
Если один ион движется значительно быстрее другого, на границе между двумя растворами накапливается разделение заряда. Это создает нежелательное напряжение, известное как потенциал жидкого перехода, который вносит значительную погрешность в ваше измерение.
Подвижности ионов K⁺ и Cl⁻ почти идентичны, что минимизирует этот потенциал перехода и обеспечивает точность измерения.
Практические преимущества и компромиссы
Использование KCl дает значительные практические преимущества, но также вносит факторы, которые должен понимать каждый аналитик.
Почему KCl удобен
Интегрированный характер KCl, обслуживающего как электродную реакцию, так и солевой мостик, позволяет создать компактную и надежную конструкцию.
Каломельный электрод не требует отдельного внешнего солевого мостика. Это упрощает его установку, использование и транспортировку по сравнению с другими опорными системами. Его потенциал также известен своей высокой стабильностью с течением времени.
Влияние концентрации
Потенциал каломельного электрода полностью зависит от концентрации KCl. Хотя насыщенный KCl является наиболее распространенным, для специфических применений также используются другие концентрации, такие как 1 М или 0,1 М.
Использование насыщенного раствора удобно, поскольку концентрация саморегулируется, но это также означает, что потенциал электрода более чувствителен к изменениям температуры, поскольку растворимость KCl меняется с температурой.
Потенциал загрязнения
Критический компромисс заключается в том, что заполняющий раствор электрода может медленно просачиваться в образец через пористый переход.
Если ваш анализ включает ионы, которые образуют осадок с хлоридом, такие как серебро (Ag⁺), свинец (Pb²⁺) или ртуть (Hg₂²⁺), утечка KCl может вызвать интерференцию и неточные результаты.
Сделайте правильный выбор для вашей цели
Понимание роли KCl помогает определить, когда каломельный электрод является подходящим инструментом для вашего конкретного электрохимического измерения.
- Если ваш основной фокус — воспроизводимость и простота использования: Насыщенный каломельный электрод (НКЭ) является отличным и классическим выбором, при условии, что ваш образец не содержит мешающих ионов и температура стабильна.
- Если ваш основной фокус — минимизация хлоридного загрязнения: Вы должны использовать другую опорную систему, например, ртутно-сульфатный электрод, в котором используется нехлоридный электролит.
- Если ваш основной фокус — производительность при различных температурах: Электрод с ненасыщенным раствором KCl (например, 3 М) обеспечивает более стабильный потенциал при изменении температуры, чем насыщенный вариант.
В конечном счете, выбор KCl является основополагающим для конструкции каломельного электрода, обеспечивая стабильную основу, необходимую для точных и надежных измерений.
Сводная таблица:
| Функция KCl | Ключевое преимущество |
|---|---|
| Устанавливает опорный потенциал | Обеспечивает стабильное, воспроизводимое напряжение через равновесие Hg₂Cl₂/Cl⁻. |
| Действует как идеальный солевой мостик | Минимизирует погрешность измерений благодаря почти равной подвижности ионов K⁺ и Cl⁻. |
| Типичная концентрация | Насыщенный раствор KCl обеспечивает постоянство концентрации, повышая воспроизводимость. |
Нужен надежный опорный электрод для электрохимического анализа в вашей лаборатории?
В KINTEK мы понимаем, что точность ваших измерений зависит от высококачественного лабораторного оборудования. Наш ассортимент электродов и расходных материалов разработан для обеспечения точности и надежности, необходимых вашей лаборатории.
Позвольте нашим экспертам помочь вам выбрать идеальное оборудование для вашего конкретного применения. Свяжитесь с KINTEK сегодня, чтобы обсудить ваши потребности и обеспечить успех вашей лаборатории!
Визуальное руководство
Связанные товары
- Каломельный, хлорсеребряный, сульфатно-ртутный электрод сравнения для лабораторного использования
- Вращающийся платиновый дисковый электрод для электрохимических применений
- Электрод из металлического диска Электрохимический электрод
- Платиновая листовая электродная система для лабораторных и промышленных применений
- Золотой дисковый электрод
Люди также спрашивают
- Как следует чистить платиновый проволочный/стержневой электрод после использования? Руководство по поддержанию оптимальной производительности
- Каково конкретное применение медной фольги в качестве катодов при восстановлении магнитов SmCo? Оптимизация результатов гальванического осаждения сплавов
- Какова функция солевого мостика в электрохимических экспериментах? Поддержание нейтральности ячейки для непрерывных реакций
- Какую роль играет RRDE в оценке катализаторов для синтеза H2O2? Повышение селективности и точности кинетики
- Какова основная функция высокочистых графитовых электродов в выщелачивании переменным током? Обеспечение эффективного извлечения металлов
- Какова правильная процедура постобработки дискового платинового электрода? Сохраните свой электрод для получения точных результатов
- Как следует обращаться с позолоченным пластинчатым электродом во время эксперимента? Обеспечьте точные и воспроизводимые результаты
- Какие характеристики делают стеклоуглеродные электроды подходящими в качестве анодов? Идеально для электролиза чистых расплавленных солей