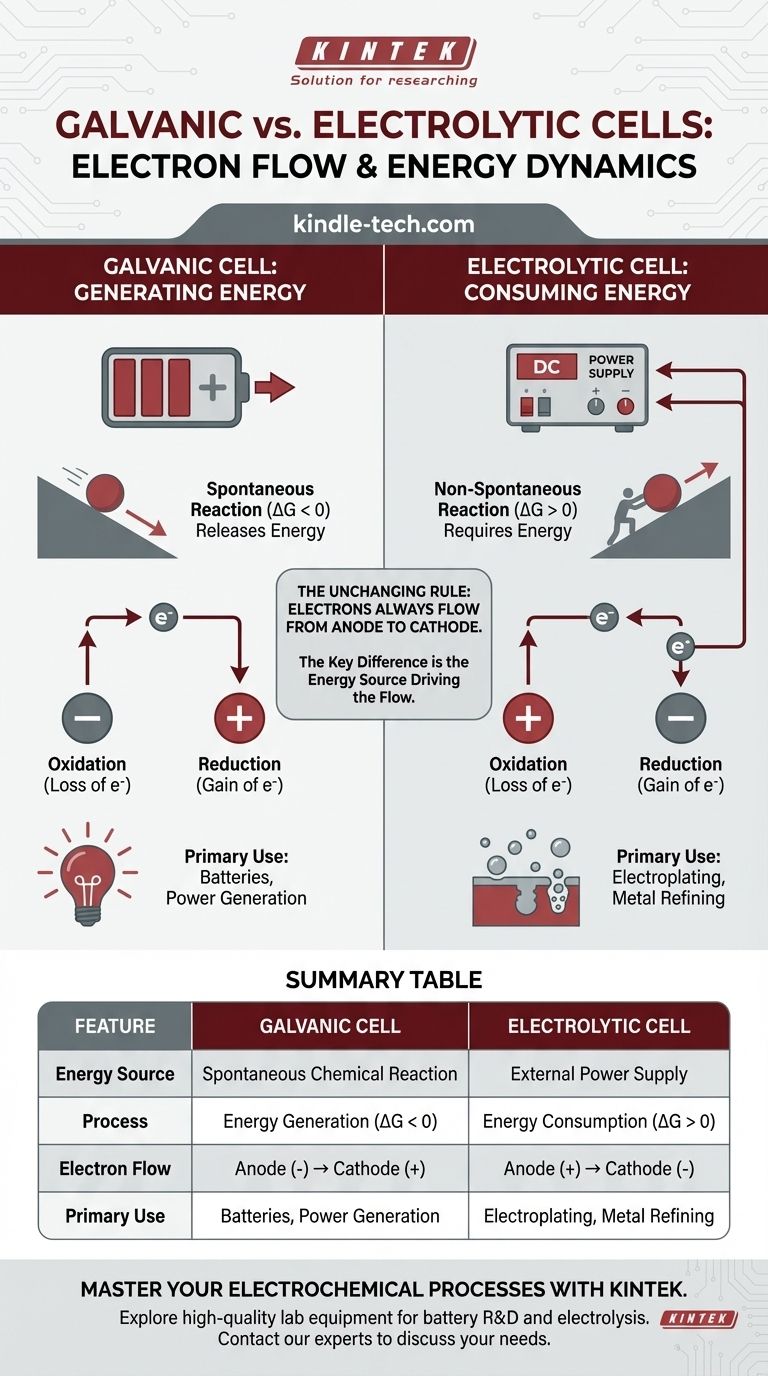
В любой электрохимической ячейке поток электронов во внешней цепи всегда направлен от анода к катоду. Критическое различие заключается в том, почему они текут. В гальваническом элементе спонтанная химическая реакция генерирует энергию и толкает электроны. В электролитическом элементе внешний источник питания обеспечивает энергию для принудительного потока электронов и запуска неспонтанной реакции.
Фундаментальное различие заключается не в направлении потока электронов относительно окисления и восстановления, а в источнике энергии, движущем процесс. Гальванический элемент преобразует запасенную химическую энергию в электрическую, в то время как электролитический элемент использует внешнюю электрическую энергию для принудительного химического изменения.

Основной принцип: спонтанные против неспонтанных реакций
Чтобы понять поток электронов, вы должны сначала понять энергетическую динамику ячейки. Вся система регулируется тем, происходит ли химическая реакция сама по себе или ее необходимо принудительно запускать.
Гальванические элементы: генерация энергии
Гальванический элемент (также называемый вольтовым элементом) использует спонтанную химическую реакцию. Представьте себе мяч, катящийся с горы — процесс естественным образом высвобождает энергию.
Эта спонтанная реакция имеет отрицательную свободную энергию Гиббса (ΔG < 0). Это высвобождение химической энергии напрямую преобразуется в электрическую энергию, выталкивая электроны от анода, через внешнюю цепь, к катоду.
Гальванические элементы являются основой всех обычных батарей.
Электролитические элементы: потребление энергии
Электролитический элемент используется для запуска неспонтанной химической реакции. Это похоже на то, как толкать мяч в гору — для этого требуется постоянный ввод внешней энергии.
Эта реакция имеет положительную свободную энергию Гиббса (ΔG > 0). Внешний источник питания, такой как батарея или блок питания, действует как «электронный насос». Он принудительно подает электроны на катод и оттягивает их от анода, запуская реакцию, которая не произошла бы сама по себе.
Деконструкция потока электронов и полярности электродов
Путаница вокруг потока электронов часто возникает из-за меняющейся полярности электродов. Хотя роли анода и катода фиксированы, их заряды — нет.
Неизменное правило: от анода к катоду
По определению, место окисления (потери электронов) всегда является анодом, а место восстановления (получения электронов) всегда является катодом.
Поскольку электроны теряются на аноде и приобретаются на катоде, электроны во внешней проволоке всегда текут от анода к катоду. Это универсальная константа для обоих типов ячеек.
Критическое различие: заряд электрода
Полярность (положительный или отрицательный заряд) электродов меняется между двумя типами ячеек, что является источником большей части путаницы.
В гальваническом элементе анод является местом спонтанного окисления, которое высвобождает электроны. Это накопление отрицательного заряда делает анод отрицательным (-) полюсом. Катод, который потребляет электроны, становится положительным (+) полюсом.
В электролитическом элементе внешний источник питания диктует полярность. Он подключает свой отрицательный полюс к катоду ячейки, чтобы принудительно подать на него электроны и вызвать восстановление. Он подключает свой положительный полюс к аноду ячейки, чтобы оттянуть электроны и вызвать окисление.
- Гальванический элемент: Анод (-) → Катод (+)
- Электролитический элемент: Анод (+) → Катод (-)
Понимание практического применения
Фундаментальное различие в преобразовании энергии определяет, как используются эти элементы. Один производит энергию, а другой потребляет ее для производства ценных материалов.
Гальванические элементы: энергия по требованию
Основное преимущество гальванического элемента — его способность действовать как портативный источник электрической энергии.
Они являются основой для батарей, от простых элементов AA до автомобильных аккумуляторов. Их главное ограничение заключается в том, что химические реагенты со временем расходуются, что приводит к падению напряжения и разрядке батареи.
Электролитические элементы: принудительное химическое изменение
Цель электролитического элемента — использовать электричество для создания химического продукта.
Этот процесс, известный как электролиз, необходим для промышленных применений, таких как рафинирование металлов (например, производство чистого алюминия), гальваническое покрытие поверхностей защитным металлическим слоем и расщепление воды на водород и кислород. Их недостатком является необходимость постоянного и часто дорогостоящего снабжения электрической энергией.
Как применить это к вашей цели
Ваш подход полностью зависит от того, нужно ли вам генерировать электричество или запускать химическую реакцию.
- Если ваша основная цель — генерация энергии или создание батареи: Вы работаете с гальваническим элементом, где спонтанная реакция производит электрический ток.
- Если ваша основная цель — очистка металла, гальваническое покрытие поверхности или расщепление соединения: Вам нужен электролитический элемент, который использует внешнюю энергию для запуска неспонтанной реакции.
- Если ваша основная цель — понять основной принцип: Помните, что окисление всегда происходит на аноде, а восстановление — на катоде; ключевое различие заключается в том, является ли реакция спонтанной (гальванический элемент) или принудительной (электролитический элемент).
Понимание этого различия между спонтанным высвобождением энергии и принудительным вводом энергии является ключом к освоению электрохимических элементов.
Сводная таблица:
| Характеристика | Гальванический элемент | Электролитический элемент |
|---|---|---|
| Источник энергии | Спонтанная химическая реакция | Внешний источник питания |
| Процесс | Генерация энергии (ΔG < 0) | Потребление энергии (ΔG > 0) |
| Поток электронов | Анод (-) → Катод (+) | Анод (+) → Катод (-) |
| Основное применение | Батареи, производство энергии | Гальванопластика, рафинирование металлов |
Освойте свои электрохимические процессы с KINTEK
Независимо от того, разрабатываете ли вы новые аккумуляторные технологии или рафинируете материалы с помощью электролиза, наличие правильного лабораторного оборудования имеет решающее значение для получения точных и надежных результатов. KINTEK специализируется на высококачественном лабораторном оборудовании и расходных материалах, предоставляя точные инструменты, необходимые для всех ваших электрохимических исследований и разработок.
Позвольте нам помочь вам оснастить вашу лабораторию для успеха. Свяжитесь с нашими экспертами сегодня, чтобы обсудить ваши конкретные потребности и узнать, как KINTEK может поддержать вашу новаторскую работу.
Визуальное руководство
Связанные товары
- Двухслойная оптическая электролитическая электрохимическая ячейка H-типа с водяной баней
- Электрохимическая ячейка для оценки покрытий
- Кварцевая электрохимическая ячейка для электрохимических экспериментов
- Электролитическая ячейка H-типа Тройная электрохимическая ячейка
- Электрохимическая ячейка из ПТФЭ, коррозионностойкая, герметичная и негерметичная
Люди также спрашивают
- Каково техническое значение процесса старения в электрохимической ячейке? Уточните структуру ваших нанотрубок
- Какие материалы используются для корпуса и крышки многофункциональной электролитической ячейки? Объяснение по поводу боросиликатного стекла высокой прочности и ПТФЭ
- Как точно контролировать реакцию в многофункциональной электролитической ячейке? Освойте трехэлектродную систему
- Каково значение использования высокоточного электролитического элемента и свинцового катода для синтеза поливанилина?
- Каковы преимущества использования пятипортовой электрохимической реакционной ячейки для оценки локализованной коррозии сплавов?
- Какие материалы используются для корпуса и крышки тонкослойной спектроэлектрохимической ячейки? Достижение точности с кварцем и ПТФЭ
- Для какого типа экспериментальной системы предназначена полностью кварцевая электролитическая ячейка? Прецизионная электрохимия в требовательных условиях
- Каково применение метода гальванопокрытия? От защиты поверхности до изготовления наноструктур



















