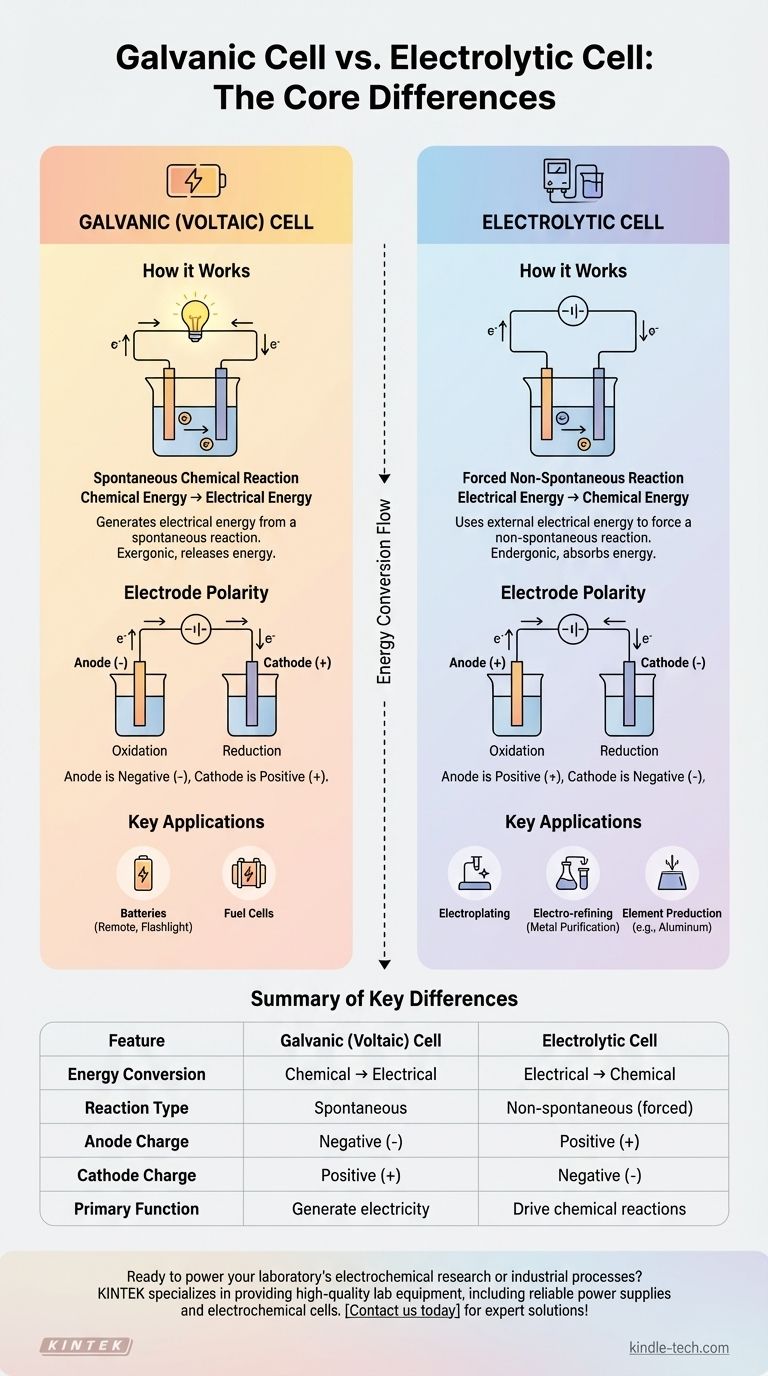
Хотя ваш вопрос упоминает две электролитические ячейки, основное различие в электрохимии проводится между электролитической ячейкой и гальванической ячейкой (также известной как вольтова ячейка). Гальваническая ячейка генерирует электрическую энергию за счет самопроизвольной химической реакции, как обычная батарея. Напротив, электролитическая ячейка использует внешний источник электрической энергии, чтобы заставить протекать несамопроизвольную химическую реакцию.
Фундаментальное различие заключается в преобразовании энергии. Гальваническая ячейка преобразует запасенную химическую энергию в электрическую, в то время как электролитическая ячейка делает прямо противоположное, преобразуя электрическую энергию в химическую для получения желаемых веществ.

Как работают гальванические (вольтовы) ячейки
Гальваническая ячейка — это замкнутая система, которая производит электричество. Подумайте о любой стандартной батарее, которую вы используете в пульте дистанционного управления или фонарике.
Самопроизвольные химические реакции
Двигателем гальванической ячейки является самопроизвольная окислительно-восстановительная (редокс) реакция. Это означает, что химическая реакция происходит естественным образом без какого-либо внешнего ввода энергии, выделяя при этом энергию.
Преобразование энергии: из химической в электрическую
Энергия, высвобождаемая в результате самопроизвольной реакции, проталкивает электроны через внешнюю цепь, создавая электрический ток. По сути, она преобразует запасенную химическую потенциальную энергию в полезную электрическую энергию.
Полярность электродов
В гальванической ячейке анод является отрицательным электродом, где происходит окисление, а катод — положительным электродом, где происходит восстановление. Электроны текут от отрицательного анода к положительному катоду.
Как работают электролитические ячейки
Электролитическая ячейка используется для проведения химических изменений, которые не произошли бы сами по себе. Этот процесс известен как электролиз.
Принуждение к несамопроизвольным реакциям
Эти ячейки предназначены для принудительного протекания несамопроизвольной реакции. Например, вода самопроизвольно не распадается на водород и кислород; для ее разделения требуется энергия.
Роль внешнего источника питания
Для проведения этой реакции электролитическая ячейка должна быть подключена к внешнему источнику питания, такому как батарея или источник постоянного тока. Этот источник обеспечивает энергию, необходимую для преодоления естественного сопротивления реакции.
Функция электролита
Ячейка содержит электролит, который обычно представляет собой расплавленную соль или солевой раствор. Это вещество содержит подвижные ионы, которые притягиваются к электродам, позволяя протекать химическим реакциям и замыкая электрическую цепь.
Промышленное применение
Этот процесс имеет решающее значение для многих промышленных применений, включая гальванопокрытие (покрытие объекта тонким слоем металла), электрорафинирование для очистки металлов, таких как медь, и получение чистых элементов, таких как алюминий из бокситовой руды.
Понимание основных различий
Сравнение этих двух ячеек бок о бок выявляет их противоположную природу. Это две стороны одной и той же электрохимической монеты.
Поток энергии и самопроизвольность
Гальваническая ячейка является экзергонической, то есть она выделяет энергию в результате самопроизвольной реакции. Электролитическая ячейка является эндергонической, то есть она поглощает энергию для проведения несамопроизвольной реакции.
Обращение полярности электродов
Это критический момент различия. Хотя окисление всегда происходит на аноде, а восстановление — на катоде, их заряды меняются на противоположные.
- В гальванической ячейке: Анод отрицательный (-), Катод положительный (+).
- В электролитической ячейке: Анод положительный (+), Катод отрицательный (-).
Это обращение происходит потому, что внешний источник питания в электролитической ячейке определяет поток электронов, переопределяя естественную тенденцию химической системы.
Сделайте правильный выбор для вашей цели
Понимание того, какую ячейку использовать, полностью зависит от того, направлена ли ваша цель на генерацию энергии или на получение химического продукта.
- Если ваш основной фокус — генерация энергии с помощью химического процесса: Вы описываете гальваническую (вольтову) ячейку, которая лежит в основе всех батарей.
- Если ваш основной фокус — использование энергии для создания вещества: Вам нужна электролитическая ячейка, которая является основой для промышленного гальванопокрытия, рафинирования и производства элементов.
- Если ваш основной фокус — понимание основ электрохимии: Помните, что гальванические ячейки выделяют энергию самопроизвольно, в то время как электролитические ячейки требуют энергии для принудительного проведения реакции.
В конечном счете, направление преобразования энергии является самым важным фактором, который определяет и разделяет эти две фундаментальные электрохимические ячейки.
Сводная таблица:
| Характеристика | Гальваническая (Вольтова) ячейка | Электролитическая ячейка |
|---|---|---|
| Преобразование энергии | Химическая → Электрическая | Электрическая → Химическая |
| Тип реакции | Самопроизвольная | Несамопроизвольная (принудительная) |
| Заряд анода | Отрицательный (-) | Положительный (+) |
| Заряд катода | Положительный (+) | Отрицательный (-) |
| Основная функция | Генерация электричества (например, батареи) | Проведение химических реакций (например, гальванопокрытие, рафинирование) |
Готовы обеспечить энергией исследования вашей лаборатории в области электрохимии или промышленные процессы? KINTEK специализируется на предоставлении высококачественного лабораторного оборудования и расходных материалов, включая надежные источники питания и электрохимические ячейки, адаптированные к вашим конкретным потребностям. Независимо от того, разрабатываете ли вы новые аккумуляторные технологии или оптимизируете системы гальванопокрытия, наш опыт гарантирует, что у вас будут правильные инструменты для успеха. Свяжитесь с нами сегодня, чтобы обсудить, как мы можем поддержать ваши проекты с помощью точного оборудования и экспертных решений!
Визуальное руководство
Связанные товары
- Электрохимическая ячейка с пятью портами
- Электрохимическая ячейка для оценки покрытий
- Двухслойная оптическая электролитическая электрохимическая ячейка H-типа с водяной баней
- Электролитическая ячейка H-типа Тройная электрохимическая ячейка
- Двухслойная пятипортовая электрохимическая ячейка с водяной баней
Люди также спрашивают
- Какие типы электродов используются в многофункциональной электролитической ячейке? Освойте трехэлектродную систему для точности
- Каковы структурные характеристики и преимущества полностью электролитической ячейки из ПТФЭ? Абсолютная химическая инертность
- Каковы типичные объемы и варианты настройки для электролитической ячейки из ПТФЭ?
- Какие типы материалов в основном подвергаются электролитическому полированию? Руководство по металлам и сплавам
- Почему точный гальваностатический режим необходим для источников питания постоянного тока в экспериментах по электрохимической очистке сточных вод?
- Какие типы электродов обычно используются в электрохимической ячейке для рамановской спектроскопии in-situ? Оптимизируйте вашу спектроскопическую установку
- Какую роль играет двухкамерная электрохимическая ячейка для пермеации при изучении диффузии водорода в стали с 9% Cr?
- Какие типы электродов используются в электролитической ячейке H-типа? Руководство по трем основным электродам



















