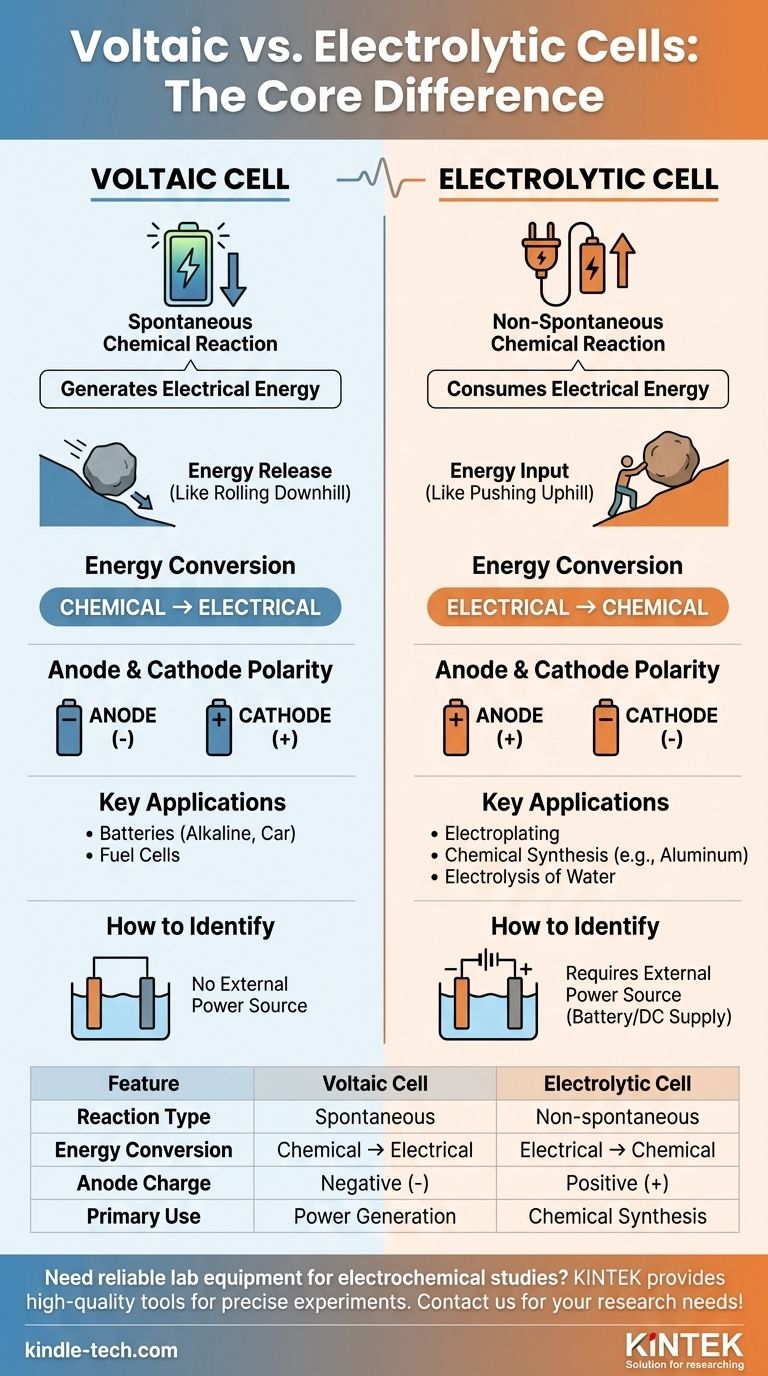
Основное различие между гальваническим элементом и электролитическим элементом заключается в их фундаментальном назначении и характере протекающих химических реакций. Гальванический элемент, такой как обычная батарея, использует спонтанную химическую реакцию для генерации электрической энергии. Напротив, электролитический элемент использует внешнюю электрическую энергию для запуска химической реакции, которая не произошла бы сама по себе.
По сути, различие заключается в потоке энергии. Гальванический элемент — это источник энергии, который высвобождает энергию из химической реакции, протекающей самопроизвольно. Электролитический элемент — это потребитель энергии, который заставляет протекать химическую реакцию, не способную к самопроизвольному протеканию.

Основной принцип: Спонтанность
Наиболее важная концепция, разделяющая эти два типа элементов, заключается в том, является ли химическая реакция спонтанной или неспонтанной. Это определяет всю функцию и структуру элемента.
Гальванические элементы: Спонтанное выделение энергии
В гальваническом элементе (также называемом вольтовым элементом) окислительно-восстановительная реакция является спонтанной. Реагенты обладают более высокой химической потенциальной энергией, чем продукты.
Эта естественная тенденция к реакции высвобождает энергию, которая используется в качестве электрического тока. Представьте себе, как валун катится с горы — это происходит без какого-либо внешнего толчка.
Стандартный электродный потенциал (E°элемента) для гальванического элемента всегда положителен, что указывает на спонтанную реакцию.
Электролитические элементы: Принудительное химическое изменение
В электролитическом элементе окислительно-восстановительная реакция является неспонтанной. Продукты находятся в более высоком энергетическом состоянии, чем реагенты.
Чтобы эта реакция произошла, необходимо приложить внешний источник питания (например, батарею или источник постоянного тока). Это похоже на то, как толкать валун в гору — это требует постоянного притока энергии.
Стандартный электродный потенциал (E°элемента) для реакции в электролитическом элементе отрицателен, что подтверждает, что она не будет протекать без внешней помощи.
Ключевые функциональные и структурные различия
Различие в спонтанности приводит к нескольким важным отличиям в том, как эти элементы строятся и как они работают.
Преобразование энергии
Гальванический элемент осуществляет преобразование химической энергии в электрическую энергию. Это химический генератор энергии.
Электролитический элемент делает прямо противоположное. Он преобразует электрическую энергию в химическую энергию, используя энергию для создания новых веществ.
Полярность анода и катода
Это частая причина путаницы, но это просто, если вы помните основные определения. В обоих типах элементов окисление всегда происходит на аноде, а восстановление всегда происходит на катоде.
Однако заряд этих электродов меняется на противоположный:
- В гальваническом элементе анод является источником электронов из спонтанной реакции, что делает его отрицательным (-) полюсом. Катод — это место, где потребляются электроны, что делает его положительным (+) полюсом.
- В электролитическом элементе внешний источник питания определяет заряд. Он толкает электроны к катоду, что делает его отрицательным (-) полюсом. Он оттягивает электроны от анода, что делает его положительным (+) полюсом.
Практическое применение
Применение каждого типа элементов напрямую отражает их функцию.
Гальванические элементы используются для питания устройств. Примеры включают повседневные щелочные батареи, автомобильные аккумуляторы (во время разряда) и топливные элементы.
Электролитические элементы используются для синтеза и очистки. Распространенные применения включают гальваническое покрытие металлов, производство чистого алюминия и электролиз воды для получения газообразных водорода и кислорода.
Распространенные ошибки и ключевые различия
Чтобы избежать распространенных ошибок, сосредоточьтесь на назначении элемента и наличии внешнего источника питания.
Назначение: Энергия против Производства
Самый простой способ различить их — по их цели. Элемент производит электричество или использует электричество для производства химического вещества? Первое — гальванический, второе — электролитический.
Роль солевого мостика
Гальванические элементы часто состоят из двух отдельных полуэлементов, соединенных солевым мостиком. Этот компонент имеет решающее значение для поддержания электрической нейтральности, поскольку ионы перемещаются во время спонтанной реакции.
Электролитические элементы обычно проще по конструкции, часто происходят в одном контейнере, где сам электролит обеспечивает движение ионов.
Внешний источник питания
Самый наглядный визуальный индикатор на схеме — это наличие батареи или источника питания. Если вы видите его подключенным к электродам, вы смотрите на электролитический элемент. Его отсутствие подразумевает гальванический элемент.
Правильный выбор для вашей цели
Чтобы определить тип элемента или понять его функцию, рассмотрите основную цель системы.
- Если ваша основная цель — питать устройство: Вы работаете с гальваническим элементом, который использует спонтанную химическую реакцию для производства тока.
- Если ваша основная цель — производить чистое вещество (например, газообразный хлор или металлическую медь): Вы используете электролитический элемент, который запускает неспонтанную реакцию с помощью внешнего источника питания.
- Если вы анализируете схему с внешней батареей: Это означает электролитический элемент, поскольку он обеспечивает необходимую энергию для принудительного химического изменения.
Понимание этого фундаментального разделения между спонтанной генерацией и принудительной реакцией является ключом к освоению электрохимии.
Сводная таблица:
| Характеристика | Гальванический элемент | Электролитический элемент |
|---|---|---|
| Тип реакции | Спонтанная | Неспонтанная (требует внешнего питания) |
| Преобразование энергии | Химическая → Электрическая | Электрическая → Химическая |
| Заряд анода | Отрицательный (-) | Положительный (+) |
| Основное применение | Производство энергии (например, батареи) | Химический синтез (например, гальваностегия) |
Нужно надежное лабораторное оборудование для ваших электрохимических исследований? KINTEK специализируется на высококачественном лабораторном оборудовании и расходных материалах, предоставляя точные инструменты, необходимые для экспериментов с гальваническими и электролитическими элементами. От электродов до источников питания, наши решения помогают обеспечить точные и воспроизводимые результаты в вашей лаборатории. Свяжитесь с нами сегодня, чтобы найти идеальное оборудование для ваших исследовательских нужд!
Визуальное руководство
Связанные товары
- Электрохимическая ячейка для оценки покрытий
- Электрохимическая ячейка с пятью портами
- Электрохимическая ячейка с газодиффузионным электролизом и ячейка для реакции с протоком жидкости
- Многофункциональная электролитическая ячейка с водяной баней, однослойная, двухслойная
- Корпус батарейки-таблетки для применений в батарейных лабораториях
Люди также спрашивают
- Как работает трехэлектродная электролитическая ячейка? Прецизионные испытания стали 8620 в коррозионных средах
- Как система электрохимической ячейки обеспечивает точность измерений при испытаниях двойным циклом электрохимической потенциокинетической реактивации (DL-EPR) супердуплексной нержавеющей стали?
- Какую роль играет электрохимическая ячейка с водяной рубашкой в измерениях электрохимической коррозии при переменной температуре?
- Как используется высокоточная электролитическая ячейка для оценки коррозионной стойкости металлов? Точная проверка результатов DCT
- В чем разница между электролитическим и электрохимическим коррозионным элементом? Понимание движущей силы коррозии













