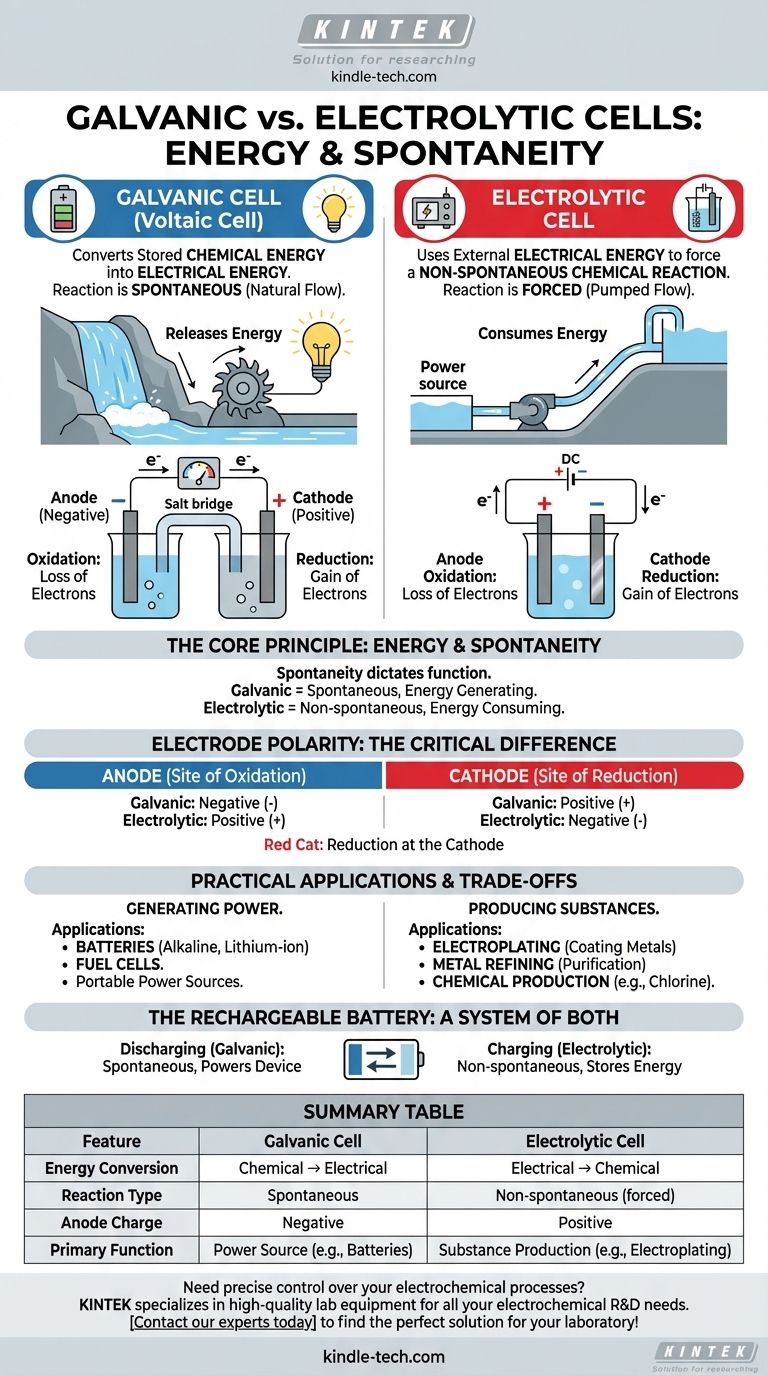
По своей сути разница между гальваническим и электролитическим элементом заключается в направлении преобразования энергии. Гальванический (или вольтов) элемент преобразует запасенную химическую энергию в электрическую посредством самопроизвольной реакции, подобно тому, как батарея питает устройство. И наоборот, электролитический элемент использует внешнюю электрическую энергию, чтобы заставить протекать несамопроизвольную химическую реакцию, например, при гальваническом нанесении покрытия.
Фундаментальное различие заключается в самопроизвольности. Гальванические элементы используют химическую реакцию, которая хочет произойти сама по себе, высвобождая энергию в виде электричества. Электролитические элементы используют электричество, чтобы заставить произойти химическую реакцию, которая в противном случае не произошла бы.

Основной принцип: энергия и самопроизвольность
Поведение любого электрохимического элемента определяется тем, является ли его внутренняя окислительно-восстановительная реакция самопроизвольной или несамопроизвольной. Этот единственный принцип диктует его функцию и структуру.
Гальванические элементы: выработка энергии
В гальваническом элементе химическая реакция является самопроизвольной. Это означает, что реагенты имеют более высокую потенциальную энергию, чем продукты, и реакция протекает естественным образом, высвобождая энергию.
Эта высвобождаемая энергия заставляет электроны двигаться через внешнюю цепь, создавая электрический ток. Представьте это как водопад: вода естественным образом течет вниз, и мы можем поставить турбину на ее пути для выработки электричества.
Электролитические элементы: потребление энергии
В электролитическом элементе желаемая химическая реакция является несамопроизвольной. Продукты находятся на более высоком энергетическом уровне, чем реагенты, поэтому реакция сама по себе не произойдет.
Чтобы заставить ее произойти, мы должны подать энергию от внешнего источника питания (например, батареи или блока питания). Это внешнее напряжение заставляет электроны двигаться против их естественного направления, вызывая реакцию. Это похоже на использование насоса для перекачки воды в гору.
Как этот принцип определяет компоненты элемента
Хотя фундаментальные определения анода и катода остаются прежними, их заряд (полярность) меняется на противоположный между двумя типами элементов. Это распространенный источник путаницы, но это прямое следствие самопроизвольности.
Анод: всегда место окисления
В обоих типах элементов анод определяется как электрод, на котором происходит окисление (потеря электронов).
Катод: всегда место восстановления
Аналогично, в обоих типах элементов катод — это электрод, на котором происходит восстановление (приобретение электронов). Простая мнемоническая фраза: «Красный Кот» (Восстановление на Катоде).
Критическое различие: полярность электродов
В гальваническом элементе самопроизвольное окисление на аноде высвобождает поток электронов. Это накопление отрицательного заряда делает анод отрицательным, а катод, который притягивает электроны, — положительным.
В электролитическом элементе используется внешний источник питания. Его положительный полюс подключается к аноду, где он принудительно оттягивает электроны от химического вещества, вызывая окисление. Следовательно, анод положительный, а катод отрицательный.
Практическое применение и компромиссы
Разница между выработкой и потреблением энергии приводит к совершенно разным практическим применениям этих двух типов элементов.
Гальванические элементы на практике: портативное питание
Гальванические элементы предназначены для использования в качестве источников питания. Их основное применение — в батареях, от одноразовых щелочных батарей до перезаряжаемых литий-ионных элементов в вашем телефоне и автомобиле.
Топливные элементы — это еще один тип гальванического элемента, который непрерывно генерирует электричество до тех пор, пока подается топливо (например, водород).
Электролитические элементы на практике: производство и рафинирование
Электролитические элементы — это промышленные «рабочие лошадки», используемые для производства материалов. Ключевые области применения включают гальваническое нанесение покрытий (покрытие объекта тонким слоем металла) и очистку таких металлов, как медь и алюминий.
Они также необходимы для производства основных промышленных химикатов, таких как хлор и гидроксид натрия из соленой воды (рассола).
Перезаряжаемая батарея: система, включающая оба элемента
Перезаряжаемая батарея — идеальная иллюстрация обоих принципов. Когда она питает ваше устройство, она действует как гальванический элемент, в котором протекает самопроизвольная реакция. Когда вы подключаете ее для зарядки, внешний источник питания обращает процесс, превращая ее в электролитический элемент для проведения несамопроизвольной химической реакции и восстановления исходных реагентов.
Выбор правильного варианта для вашей цели
Ваше понимание того, какой элемент следует рассмотреть, полностью зависит от того, нужно ли вам производить энергию или производить вещество.
- Если ваша основная цель — выработка энергии в результате химической реакции: вы работаете с гальваническим элементом, где самопроизвольный процесс создает электрический ток.
- Если ваша основная цель — создание вещества с использованием электричества: вы используете электролитический элемент, где внешнее напряжение вызывает несамопроизвольное химическое изменение.
- Если ваша основная цель — хранение и повторное использование электрической энергии: вы имеете дело с перезаряжаемой системой, которая попеременно является электролитическим элементом (зарядка) и гальваническим элементом (разрядка).
В конечном счете, эти два типа элементов — две стороны одной электрохимической монеты, определяемые направлением потока энергии.
Сводная таблица:
| Характеристика | Гальванический элемент | Электролитический элемент |
|---|---|---|
| Преобразование энергии | Химическая → Электрическая | Электрическая → Химическая |
| Тип реакции | Самопроизвольная | Несамопроизвольная (принудительная) |
| Заряд анода | Отрицательный | Положительный |
| Основная функция | Источник питания (например, батареи) | Производство веществ (например, гальваническое покрытие) |
Нужен точный контроль над вашими электрохимическими процессами? Правильное лабораторное оборудование имеет решающее значение для получения точных результатов, независимо от того, разрабатываете ли вы новые материалы для батарей или совершенствуете методы нанесения металлического покрытия. KINTEK специализируется на высококачественном лабораторном оборудовании и расходных материалах для всех ваших нужд в области электрохимических исследований и разработок. Свяжитесь с нашими экспертами сегодня, чтобы найти идеальное решение для вашей лаборатории!
Визуальное руководство
Связанные товары
- Электрохимическая ячейка для оценки покрытий
- Электрохимическая ячейка с пятью портами
- Двухслойная оптическая электролитическая электрохимическая ячейка H-типа с водяной баней
- Электрохимическая ячейка с газодиффузионным электролизом и ячейка для реакции с протоком жидкости
- Многофункциональная электролитическая ячейка с водяной баней, однослойная, двухслойная
Люди также спрашивают
- Какова функция электролитической ячейки в цикле Cu-Cl? Оптимизация производства водорода и энергоэффективности
- Какова основная функция однокамерного циркуляционного электролитического реактора лабораторного масштаба? Оптимизация рекуперации алюминия
- Как следует обращаться с тонкослойной спектроэлектрохимической ячейкой для обеспечения ее долговечности? Советы экспертов по техническому обслуживанию
- Каковы полные шаги подготовки, которые необходимо предпринять перед использованием электрохимической ячейки с плоской пластиной для коррозионных испытаний? Обеспечьте точные и воспроизводимые результаты
- Как следует очищать многократно используемую электролитическую ячейку? Освойте 3-этапный протокол для получения надежных результатов
- Какие общие меры предосторожности следует соблюдать при использовании ячейки для тонкослойной спектроэлектрохимии? Обеспечьте точные результаты и безопасность оборудования
- Как диафрагменный электролитический элемент функционирует в бетоне с радиационной защитой? Оптимизация плотности с активной водой
- Как конструкция электролитической ячейки способствует моделированию промышленных водородных сред? Руководство эксперта







