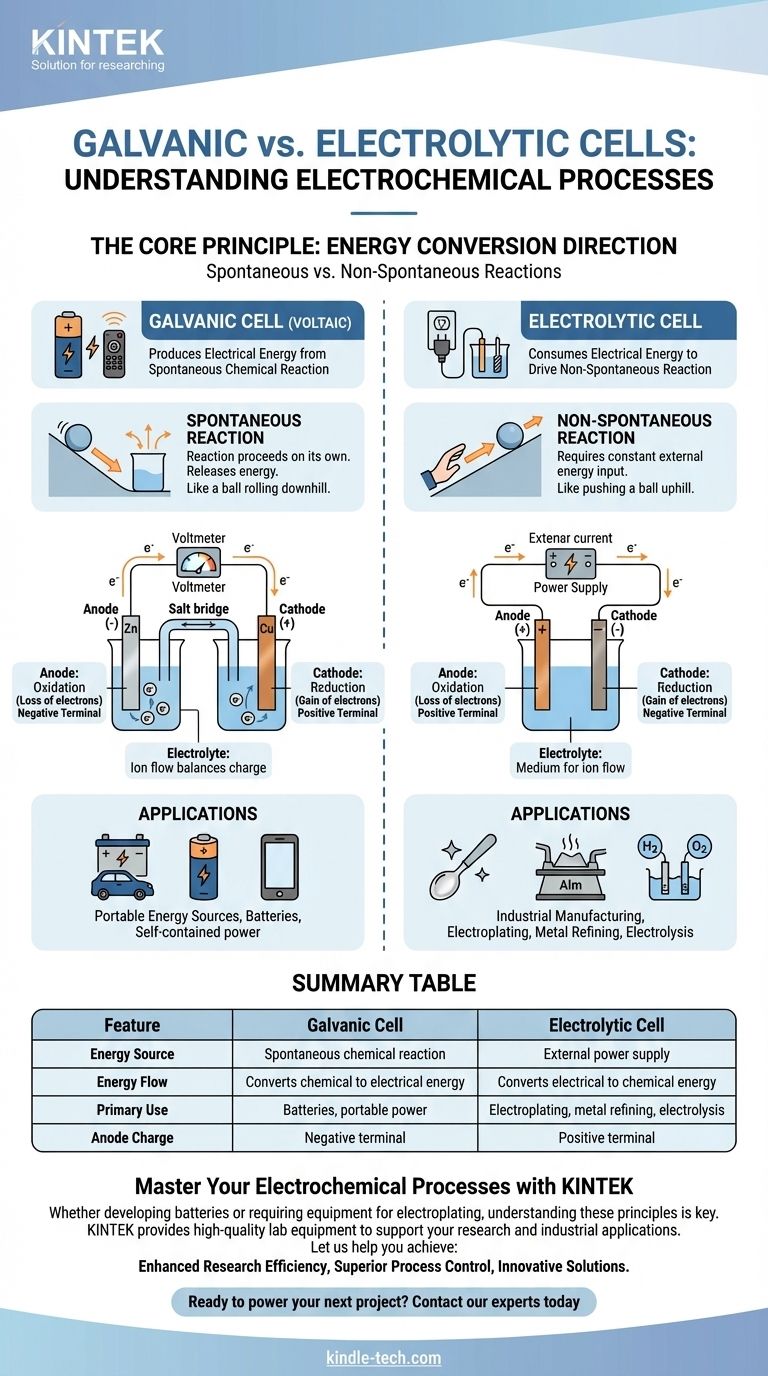
По своей сути гальванический элемент — это электрохимическая ячейка, которая вырабатывает электрическую энергию в результате самопроизвольной химической реакции, подобно батарейке, питающей ваш пульт. И наоборот, электролитическая ячейка потребляет электрическую энергию из внешнего источника, чтобы заставить произойти несамопроизвольную химическую реакцию, что используется при нанесении гальванических покрытий и очистке металлов.
Фундаментальное различие заключается в направлении преобразования энергии. Гальванический элемент преобразует запасенную химическую энергию в электрическую, тогда как электролитическая ячейка преобразует внешнюю электрическую энергию в химическую.

Основной принцип: самопроизвольные против несамопроизвольных реакций
Поведение любой электрохимической ячейки определяется естественной склонностью ее химической реакции. Эта склонность является ключом к пониманию того, почему одна ячейка производит энергию, а другая в ней нуждается.
Как гальванические элементы генерируют энергию
Гальванический элемент, также известный как вольтов элемент, построен на основе самопроизвольной химической реакции.
Это реакция, которая протекает сама по себе без внешнего вмешательства, выделяя при этом энергию. Представьте это как скатывающийся с горы мяч.
Это высвобождение энергии выталкивает электроны через внешнюю цепь, создавая электрический ток. Это принцип, лежащий в основе всех неперезаряжаемых и разряжающихся перезаряжаемых батарей.
Как электролитические ячейки потребляют энергию
Электролитическая ячейка приводит в действие несамопроизвольную химическую реакцию.
Это реакция, которая не произойдет сама по себе и требует постоянного притока энергии для протекания. Это эквивалентно толканию мяча в гору.
Внешний источник питания, например блок питания, обеспечивает необходимое напряжение, чтобы заставить электроны течь против их естественного направления, вызывая желаемое химическое изменение.
Практический взгляд на работу ячеек
Хотя их цели противоположны, обе ячейки имеют общие компоненты, которые работают по одним и тем же основным правилам химии, но с критической разницей в полярности.
Анод и катод: история двух полярностей
В обоих типах ячеек анод — это всегда место, где происходит окисление (потеря электронов), а катод — место, где происходит восстановление (приобретение электронов).
Однако их электрический заряд меняется на противоположный. В гальваническом элементе анод является отрицательным полюсом, потому что самопроизвольная реакция высвобождает электроны с него.
В электролитической ячейке анод является положительным полюсом, потому что внешний источник питания оттягивает от него электроны, заставляя происходить окисление.
Роль электролита
Обе ячейки содержат электролит, как правило, раствор, содержащий ионы.
Эта среда необходима для завершения электрической цепи. В то время как электроны текут по внешней проволоке, ионы текут через электролит для выравнивания заряда на электродах.
Понимание применений и компромиссов
Противоположные функции этих ячеек приводят к совершенно разным практическим применениям и присущим им ограничениям.
Гальванические элементы: портативные источники энергии
Основное применение гальванических элементов — служить батареями. Они обеспечивают портативный, автономный источник электрической энергии.
Обратная сторона заключается в том, что химические реагенты внутри ячейки конечны. Как только они израсходованы, ячейка перестает вырабатывать энергию и должна быть либо утилизирована, либо перезаряжена.
Электролитические ячейки: промышленное производство и очистка
Электролитические ячейки являются рабочими лошадками промышленности, используемыми для процессов, которые в противном случае были бы химически невозможны или неэффективны.
Ключевые области применения включают гальванотехнику (покрытие одного металла другим), рафинирование металлов, таких как алюминий и медь, а также электролиз воды для получения водорода и кислорода. Их главный недостаток — потребность в значительном и непрерывном источнике внешней электрической энергии.
Как применить эти знания
Ваш выбор между этими концепциями полностью зависит от того, направлена ли ваша цель на выработку энергии или на инициирование химического изменения.
- Если ваше основное внимание уделяется выработке электричества в результате химической реакции: вы работаете с принципами гальванического элемента, например, при разработке или понимании работы батареи.
- Если ваше основное внимание уделяется использованию электричества для создания продукта или очистки вещества: вы работаете с принципами электролитической ячейки, что распространено в химическом производстве и металлургии.
Понимание этого разделения — первый шаг к овладению практическим применением электрохимии.
Сводная таблица:
| Характеристика | Гальванический элемент | Электролитическая ячейка |
|---|---|---|
| Источник энергии | Самопроизвольная химическая реакция | Внешний источник питания |
| Поток энергии | Преобразует химическую энергию в электрическую | Преобразует электрическую энергию в химическую |
| Основное применение | Батареи, портативное питание | Гальванотехника, рафинирование металлов, электролиз |
| Заряд анода | Отрицательный полюс | Положительный полюс |
Освойте свои электрохимические процессы с KINTEK
Независимо от того, разрабатываете ли вы новые аккумуляторные технологии или нуждаетесь в точном оборудовании для гальванотехники и очистки металлов, понимание этих основных электрохимических принципов — это только начало. KINTEK специализируется на предоставлении высококачественного лабораторного оборудования и расходных материалов для поддержки ваших исследований и промышленных применений.
Позвольте нам помочь вам достичь:
- Повышенной эффективности исследований: С надежным оборудованием для тестирования и разработки как гальванических, так и электролитических систем.
- Превосходного контроля процессов: Для получения стабильных результатов в гальванотехнике, электролизе и синтезе материалов.
- Инновационных решений: Адаптированных к уникальным потребностям лабораторий и производственных помещений.
Готовы запустить свой следующий проект? Свяжитесь с нашими экспертами сегодня, чтобы найти идеальное решение для ваших лабораторных нужд!
Визуальное руководство
Связанные товары
- Двухслойная оптическая электролитическая электрохимическая ячейка H-типа с водяной баней
- Электрохимическая ячейка для оценки покрытий
- Кварцевая электрохимическая ячейка для электрохимических экспериментов
- Электролитическая ячейка H-типа Тройная электрохимическая ячейка
- Электрохимическая ячейка из ПТФЭ, коррозионностойкая, герметичная и негерметичная
Люди также спрашивают
- Как электрохимическая рабочая станция оценивает коррозионную стойкость сварных соединений? Руководство по экспертному тестированию
- Каковы основные функции индивидуальных силиконовых прокладок в электрохимической проточной ячейке? Ключ к точному анализу
- Какие проверки следует выполнить перед использованием электролитической ячейки? Обеспечьте безопасность и точность в вашей лаборатории
- Какие доступны объемы и размеры для полностью кварцевой электролитической ячейки? Найдите идеальный вариант для вашей лаборатории
- Почему в конструкции катода фотоэлектрохимических реакторов используются сложенные и повернутые сетки из нержавеющей стали?
- Как потенциостатическая система электролитического травления оценивает сенсибилизацию AISI 316Ti? Соответствие стандарту ASTM A262
- Что такое электролиз как метод очистки воды? Руководство по электрохимической очистке
- Как следует обращаться с электролитическими ячейками H-типа со стеклянными компонентами? Руководство по безопасному и долговечному использованию



















