По своей сути коррозия — это естественная деградация очищенного металла в более химически стабильную форму, например, в его оксид или сульфид. В электрохимической ячейке этот процесс является не просто поверхностной реакцией, а полным контуром, в котором металл по сути самоуничтожается, создавая крошечную нежелательную батарею на собственной поверхности.
Коррозия является электрохимическим процессом, поскольку она включает в себя четыре основных компонента батареи: анод (где теряется металл), катод, электролит (например, вода) и металлический путь, которые работают вместе для разрушения металла.
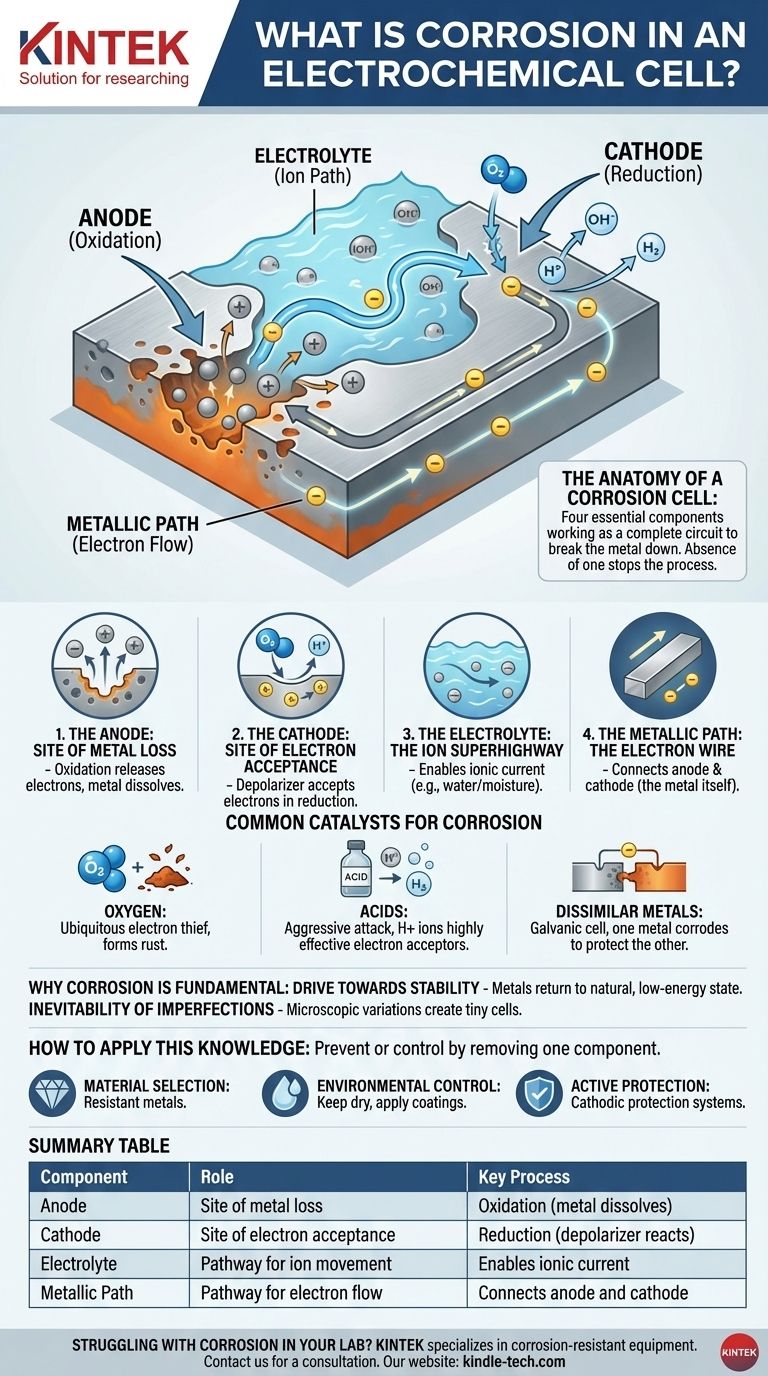
Анатомия коррозионной ячейки
Понять коррозию — значит понять четыре компонента, необходимые для ее функционирования. Отсутствие любого из этих компонентов полностью остановит процесс.
Анод: Место потери металла
Анодный участок — это определенное место на поверхности металла, где происходит коррозия. Здесь атомы металла подвергаются окислению, теряя электроны и превращаясь в положительно заряженные ионы, которые растворяются в окружающей воде или влаге. Это физический акт разъедания металла.
Катод: Место приема электронов
Электроны, высвобождаемые анодом, проходят через металл к другому месту — катодному участку. Здесь вещество в окружающей среде — известное как деполяризатор — принимает эти электроны в ходе реакции восстановления. Этот деполяризатор является критически важным ингредиентом.
Электролит: Скоростная магистраль для ионов
Вода, даже в микроскопических количествах, таких как влажность, действует как электролит. Она обеспечивает среду для перемещения растворенных ионов металла (из анода) и других ионов, замыкая электрическую цепь. Без электролита ионы не могут двигаться, и цепь разрывается.
Металлический путь: Проводник электронов
Сам металл служит металлическим путем. Он обеспечивает проводящий путь для электронов, чтобы они могли перемещаться от анода к катоду. Вот почему анодные и катодные участки могут находиться прямо рядом друг с другом или далеко друг от друга на одном и том же куске металла.
Общие катализаторы коррозии
Скорость и степень коррозии часто определяются наличием и типом деполяризатора (акцептора электронов) на катоде.
Кислород: Повсеместный вор электронов
В большинстве обычных сред растворенный кислород является основным акцептором электронов. Вот почему вода и кислород вместе так разрушительны для таких металлов, как железо, что приводит к образованию ржавчины (оксида железа).
Кислоты: Агрессивная атака
Кислоты резко ускоряют коррозию. Ионы водорода (H+) в кислом растворе являются высокоэффективными акцепторами электронов, образуя водородный газ на катоде. Этот процесс, как правило, намного быстрее и агрессивнее, чем коррозия, вызванная кислородом.
Различные металлы: Гальваническая ячейка
Когда два разных металла находятся в электрическом контакте внутри электролита, они образуют гальваническую ячейку. Менее благородный, более активный металл становится анодом и быстро корродирует, в то время как более благородный металл становится катодом и защищается. Вот почему вы видите жертвенные цинковые аноды на корпусах лодок для защиты стали.
Почему коррозия является фундаментальным процессом
Коррозия — это не дефект; это естественный и спонтанный процесс, обусловленный фундаментальными законами термодинамики. Понимание этой неизбежности является ключом к управлению ею.
Стремление к стабильности
Очищенные металлы, такие как алюминий и сталь, являются искусственными материалами, находящимися в состоянии высокой энергии. Коррозия — это просто процесс возвращения этого металла в его естественное состояние низкой энергии, похожее на руду, из которой он был извлечен. Металл высвобождает запасенную энергию.
Неизбежность несовершенств
Ни одна металлическая поверхность не является идеально однородной. Микроскопические различия в составе, напряжение от производства или даже различия в воздействии кислорода создают крошечные анодные и катодные участки по всей поверхности. Эти несовершенства — все, что нужно для инициирования тысяч микроскопических коррозионных ячеек.
Как применить эти знания
Понимание того, что коррозия является электрохимической ячейкой, дает вам четкую основу для ее предотвращения или контроля. Стратегия всегда заключается в устранении одного из четырех основных компонентов.
- Если ваше основное внимание уделяется выбору материала: Используйте металлы, которые по своей природе устойчивы к образованию электрохимической ячейки в условиях эксплуатации, или избегайте соединения разнородных металлов.
- Если ваше основное внимание уделяется контролю окружающей среды: Устраните электролит, сохраняя металл сухим, или нанесите водонепроницаемое покрытие (например, краску), чтобы предотвратить попадание влаги на поверхность.
- Если ваше основное внимание уделяется активной защите: Намеренно создайте более мощную электрохимическую ячейку, в которой ваш конструкционный металл вынужден быть катодом. Это принцип, лежащий в основе как жертвенных анодов, так и систем катодной защиты.
Рассматривая коррозию как простую цепь, вы можете систематически диагностировать ее причину и эффективно прервать ее разрушительный путь.

Сводная таблица:
| Компонент | Роль в коррозионной ячейке | Ключевой процесс |
|---|---|---|
| Анод | Место потери металла | Окисление (металл растворяется) |
| Катод | Место приема электронов | Восстановление (деполяризатор реагирует) |
| Электролит | Путь для движения ионов | Обеспечивает ионный ток (например, вода) |
| Металлический путь | Путь для потока электронов | Соединяет анод и катод (сам металл) |
Сталкиваетесь с коррозией лабораторного оборудования?
Коррозия может поставить под угрозу ваши эксперименты, повредить чувствительное оборудование и привести к дорогостоящим простоям. KINTEK специализируется на коррозионностойком лабораторном оборудовании и расходных материалах, помогая вам защитить ваши инвестиции и обеспечить целостность ваших исследований.
Наши эксперты могут помочь вам выбрать правильные материалы и решения для прерывания цепи коррозии в вашей конкретной лабораторной среде.
Свяжитесь с KINTEK сегодня для консультации и узнайте, как мы можем помочь вам бороться с коррозией и повысить производительность вашей лаборатории.
Визуальное руководство
Связанные товары
- Электрохимическая ячейка для оценки покрытий
- Электрохимическая ячейка для электролиза плоской коррозии
- Кварцевая электрохимическая ячейка для электрохимических экспериментов
- Двухслойная оптическая электролитическая электрохимическая ячейка H-типа с водяной баней
- Электрохимическая ячейка для спектроэлектролиза в тонком слое
Люди также спрашивают
- Какова функция трехкамерной электролитической ячейки H-типа? Разблокируйте сложные многостадийные электрохимические реакции
- Как управляется электролит в электролитических ячейках H-типа для конкретных реакций? Достижение точного контроля и высокой чистоты
- Какую роль играют никелированные биполярные пластины в стеке электролизера? Повышение эффективности и долговечности
- Каковы основные функции электролитической ячейки и электродной системы в синтезе МОФ? Достижение высокочистых пленок
- Как ячейка для испытаний проводимости с медными электродами и кольцами из ПТФЭ облегчает характеризацию фторированных углеродных аэрогелей?
- Почему потенциостат или гальваностат незаменимы для оценки коррозионной стойкости высокоэнтропийных сплавных покрытий?
- Какую роль играет трехэлектродная стеклянная электролитическая ячейка в катализаторах IrSn/MMT? Оптимизация производительности скрининга OER
- Как источник постоянного тока и электролитическая ячейка сотрудничают для оценки водородного охрупчивания сплавов?



















