В любой электрохимической системе двумя наиболее важными мерами предосторожности являются обеспечение правильной полярности электродов и выбор подходящего электролита для вашей реакции. Полярность определяет, какой химический процесс происходит где, в то время как электролит обеспечивает необходимую среду для этого процесса. Ошибка в любом из них может привести к неудачным экспериментам, повреждению оборудования или значительной угрозе безопасности.
Полярность ваших электродов определяет направление химической реакции, а электролит — ее осуществимость. Несоответствие одного из них фундаментально изменит, затормозит или активно исказит предполагаемый электрохимический процесс.
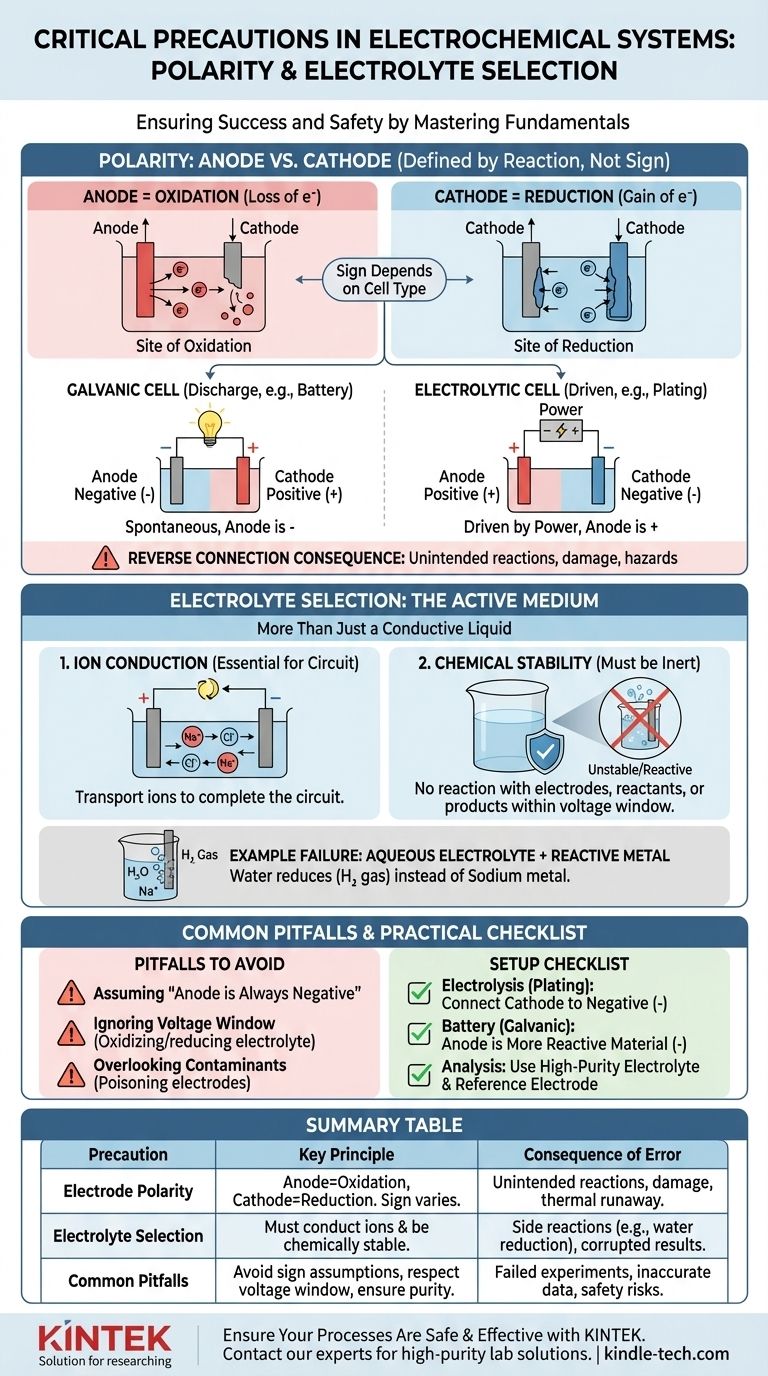
Критическая роль полярности: анод против катода
Правильное определение анода и катода — первый шаг к созданию функциональной и предсказуемой электрохимической ячейки. Это выходит за рамки простого обозначения клемм как «положительных» или «отрицательных».
Что на самом деле означает «полярность»
Термины анод и катод определяются типом реакции, а не их зарядом.
- Анод — это всегда место окисления (потери электронов).
- Катод — это всегда место восстановления (приобретения электронов).
Путаница возникает потому, что знак (+ или -) этих электродов зависит от типа ячейки. В разряжающейся батарее (гальванической ячейке) анод является отрицательной клеммой. При электролизе (электролитической ячейке) анод подключается к положительной клемме источника питания.
Последствия обратного подключения
Неправильное подключение электродов заставляет химические реакции протекать в обратном или непредусмотренном направлении.
В электролитической ячейке (например, при гальванопокрытии) обратное подключение означает, что вы снимете материал с электрода, который вы намеревались покрыть, и отложите материал на вашем исходном аноде, уничтожив оба.
В перезаряжаемой батарее зарядка с обратной полярностью может вызвать необратимое повреждение структур электродов, что приведет к необратимой потере емкости, внутренним коротким замыканиям и потенциально опасному тепловому разгону.
Выбор электролита: больше, чем просто проводящая жидкость
Электролит не является пассивным компонентом; это активная и критически важная часть электрохимической системы. Его свойства определяют, какие реакции вообще возможны.
Основная функция: ионная проводимость
Самая базовая задача электролита — переносить ионы между анодом и катодом, замыкая электрическую цепь. Без среды для ионного потока вся реакция немедленно прекратится.
Критическая функция: химическая стабильность
Электролит и его растворитель должны быть химически инертными в рабочих условиях. Они не должны вступать в реакцию с электродами, реагентами или продуктами вашей основной реакции. Это источник «нежелательных побочных реакций», упоминаемых в протоколах безопасности.
Пример: почему водные электролиты не подходят для реактивных металлов
Представьте, что вы пытаетесь получить металлический натрий путем электролиза раствора хлорида натрия (NaCl) в воде.
Вы можете ожидать, что ионы натрия (Na+) переместятся к катоду, примут электрон и образуют металлический натрий. Однако вода (H₂O) также присутствует, и ее восстановить намного легче, чем ионы натрия. В результате на катоде будет выделяться газообразный водород, и металлический натрий не образуется. Выбор электролита сделал желаемую реакцию невозможной.
Понимание компромиссов и распространенных ошибок
Избежание простых ошибок требует понимания основных принципов, управляющих всеми электрохимическими ячейками.
Ошибка 1: Предположение, что «анод всегда отрицательный»
Самая распространенная ошибка — неправильное определение анода и катода. Всегда помните, что определять их нужно по реакции (окисление/восстановление), а не по фиксированному знаку. Определите, является ли ваша ячейка гальванической (самопроизвольной) или электролитической (управляемой внешним питанием), чтобы присвоить правильный знак.
Ошибка 2: Игнорирование рабочего диапазона напряжения электролита
Каждый электролит имеет рабочий диапазон потенциалов стабильности. Если вы прикладываете напряжение, превышающее этот диапазон, вы начнете окислять или восстанавливать сам электролит, а не вашу предполагаемую цель. Это потребляет энергию, создает примеси и останавливает желаемую реакцию.
Ошибка 3: Недооценка загрязняющих веществ
Даже следовые количества примесей в электролите могут иметь огромное значение. Загрязнители могут оседать на поверхности электрода, «отравляя» его и предотвращая предполагаемую реакцию, или они могут действовать как катализаторы нежелательных побочных реакций, которые искажают ваши результаты.
Практический контрольный список для вашей установки
Используйте эти рекомендации, чтобы с самого начала обеспечить правильность вашей экспериментальной установки.
- Если ваша основная цель — электролиз (например, нанесение покрытия, рафинирование): Подключите электрод, на который вы хотите нанести покрытие (катод), к отрицательной клемме источника питания, а исходный материал (анод) — к положительной клемме.
- Если ваша основная цель — создание батареи (гальванической ячейки): Более химически активный материал, который окисляется, является вашим анодом (отрицательная клемма), а менее активный материал — вашим катодом (положительная клемма).
- Если ваша основная цель — точный электрохимический анализ: Используйте высокочистый, часто дегазированный электролит для предотвращения побочных реакций и подтвердите схему полярности относительно известного стандарта или электрода сравнения.
Рассматривая выбор полярности и электролита как фундаментальные параметры проектирования, вы переходите от простого следования инструкциям к истинному конструированию желаемого электрохимического результата.

Сводная таблица:
| Мера предосторожности | Ключевой принцип | Последствия ошибки |
|---|---|---|
| Полярность электродов | Анод = место окисления; Катод = место восстановления. Знак зависит от типа ячейки (гальваническая против электролитической). | Обратное подключение вызывает непреднамеренные реакции (например, снятие покрытия вместо нанесения), повреждение оборудования или тепловой разгон. |
| Выбор электролита | Должен проводить ионы и оставаться химически стабильным в рабочих условиях (рабочий диапазон напряжения). | Неправильный электролит вызывает побочные реакции (например, восстановление воды вместо осаждения натрия), искажает результаты и расходует энергию. |
| Распространенные ошибки | Предположение, что «анод всегда отрицательный»; игнорирование рабочего диапазона напряжения электролита; недооценка загрязняющих веществ. | Неудачные эксперименты, неточные данные и риски для безопасности из-за непреднамеренных химических процессов. |
Обеспечьте безопасность и эффективность ваших электрохимических процессов с KINTEK
Вы настраиваете проект по электролизу, нанесению покрытий или разработке батарей? Правильная полярность электродов и выбор электролита являются обязательными условиями для достижения точных результатов и обеспечения безопасности. KINTEK специализируется на предоставлении высокочистого лабораторного оборудования и расходных материалов — включая электрохимические ячейки, чистые электролиты и надежные источники питания — для поддержки уникальных потребностей вашей лаборатории.
Позвольте нам помочь вам избежать дорогостоящих ошибок и опасностей. Свяжитесь с нашими экспертами сегодня, чтобы обсудить ваше конкретное применение и узнать, как решения KINTEK могут улучшить ваш электрохимический рабочий процесс.
Визуальное руководство
Связанные товары
- Вращающийся платиновый дисковый электрод для электрохимических применений
- Золотой дисковый электрод
- Сульфатно-медный электрод сравнения для лабораторного использования
- Платиновый вспомогательный электрод для лабораторного использования
- Никель-алюминиевые вкладки для литий-ионных аккумуляторов в мягкой упаковке
Люди также спрашивают
- Каковы технические характеристики функционального платино-титанового электрода? Максимизация электрохимических характеристик
- В чем разница между RDE и RRDE? Разблокируйте расширенный анализ электрохимических реакций
- Какова общая роль платинового дискового электрода? Руководство по его основному использованию в качестве рабочего электрода
- Что такое ВДКЭ в электрохимии? Откройте подробные пути реакций с помощью двухэлектродного анализа
- Какова разница между дисковым вращающимся электродом и вращающимся дисковым электродом? Раскройте более глубокие электрохимические закономерности



















