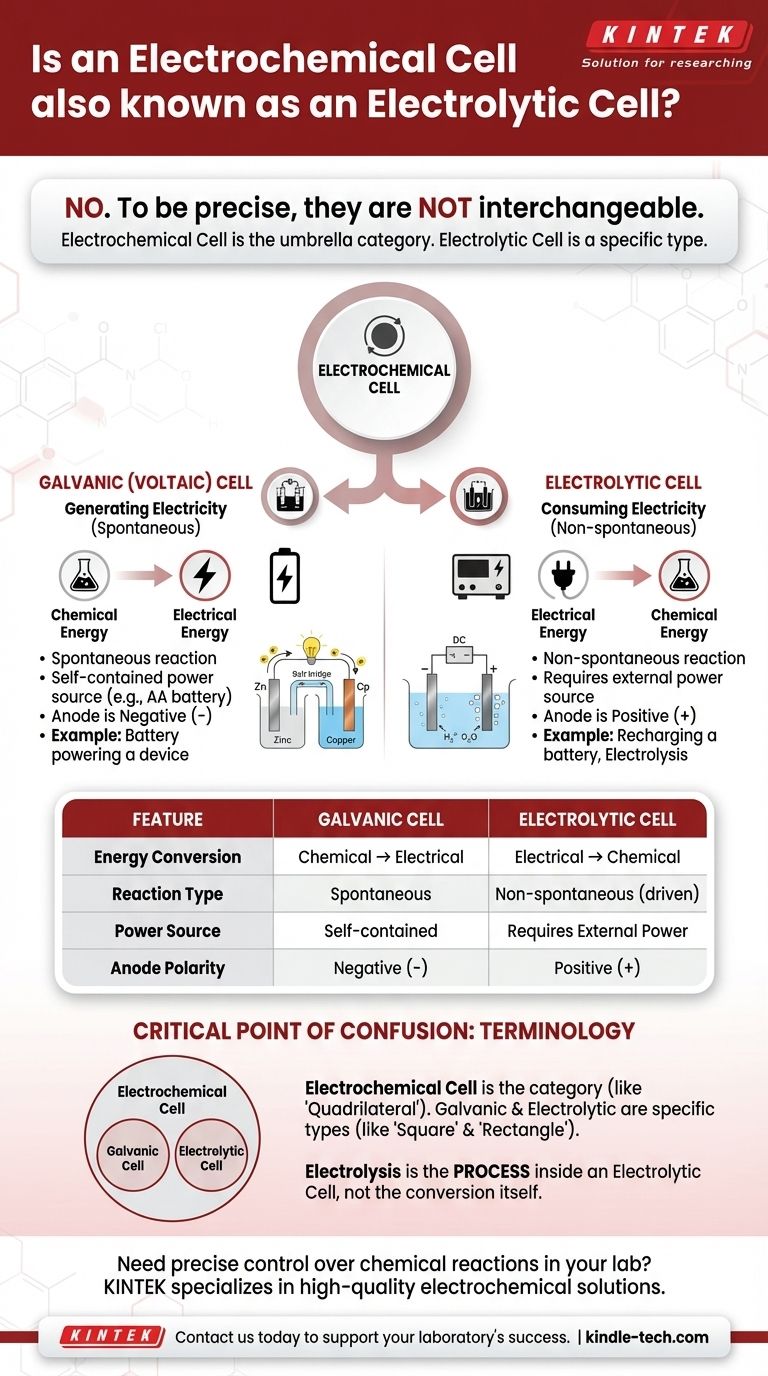
Если быть точным, то нет. Электролитическая ячейка — это конкретный тип электрохимической ячейки, но эти два термина не взаимозаменяемы. «Электрохимическая ячейка» — это широкая, общая категория для любого устройства, которое преобразует химическую энергию в электрическую или наоборот. Электролитические ячейки — это те, которые специально используют электрическую энергию для инициирования химической реакции.
Основное различие заключается в направлении преобразования энергии. Гальванический (или вольтов) элемент спонтанно высвобождает энергию химической реакции для создания электричества. Электролитический элемент потребляет электричество из внешнего источника, чтобы заставить произойти химическую реакцию.

Основное различие: Поток энергии
Классификация определяется назначением электрохимической ячейки. Главный вопрос, который следует задать: производит ли ячейка энергию или потребляет ее?
Гальванические (Вольтовы) Элементы: Генерация Электричества
Гальванический элемент, также известный как вольтов элемент, использует спонтанную химическую реакцию.
Реагенты внутри ячейки обладают естественной склонностью к реакции, высвобождая при этом энергию. Эта энергия улавливается в виде электрического тока.
Представьте себе стандартную батарейку АА в пульте дистанционного управления. Это гальванический элемент, преобразующий свою внутреннюю химическую энергию в электрическую энергию, необходимую для питания пульта.
Электролитические Элементы: Потребление Электричества
Электролитический элемент использует внешний источник электрической энергии (например, блок питания) для протекания неспонтанной химической реакции.
Без этого внешнего питания химическая реакция не произошла бы сама по себе. Электричество заставляет реакцию протекать вопреки ее естественной тенденции.
Распространенным примером является электролиз, например, расщепление воды на водород и кислород. Другим примером является перезарядка литий-ионного аккумулятора; вы используете электричество, чтобы обратить реакцию разряда и восстановить его химический потенциал.
Ключевые идентификаторы для каждого типа ячеек
Помимо направления потока энергии, несколько технических характеристик помогают различать два типа ячеек.
Роль Внешнего Источника Питания
Это самый простой показатель. Если устройство автономно и действует как источник питания, это гальванический элемент.
Если устройство должно быть подключено к внешнему источнику питания для работы, это электролитический элемент.
Полярность Анода и Катода
Хотя определения анода (где происходит окисление) и катода (где происходит восстановление) остаются постоянными, их электрический заряд (полярность) меняется между двумя типами ячеек.
В гальваническом элементе анод является отрицательным (-) выводом, а катод — положительным (+) выводом.
В электролитическом элементе внешний источник питания меняет это местами. Анод становится положительным (+) выводом, а катод — отрицательным (-) выводом.
Критический момент путаницы: Терминология
Основной источник путаницы проистекает из пересекающегося, но различного характера терминов. Неспособность их различить приводит к фундаментальным недопониманиям.
«Электрохимическая ячейка» — это Общий Термин
Представьте «электрохимическую ячейку» как общую категорию, подобную «четырехугольнику».
Гальванические и электролитические ячейки — это конкретные типы внутри этой категории, подобно тому, как «квадрат» и «прямоугольник» являются конкретными типами четырехугольников. Электролитическая ячейка всегда является электрохимической ячейкой, но не все электрохимические ячейки являются электролитическими.
Неправильное Использование Термина «Электролиз»
Электролиз — это процесс использования электричества для проведения химической реакции. Этот процесс происходит внутри электролитической ячейки.
Некоторые определения ошибочно утверждают, что электролиз — это преобразование химической энергии в электрическую. Это прямо противоположно истине. Электролиз по существу связан с использованием электричества для создания химического изменения.
Как Сделать Правильное Различие для Вашей Цели
Чтобы правильно применить эти знания, просто определите основную функцию устройства, которое вы анализируете.
- Если ваше внимание сосредоточено на устройстве, которое что-то питает (пульт, телефон, часы): Вы имеете дело с гальваническим (вольтовым) элементом, который преобразует запасенную химическую энергию в электричество.
- Если ваше внимание сосредоточено на процессе, который использует электричество для создания вещества (перезарядка аккумулятора, нанесение металлического покрытия, производство газообразного хлора): Вы имеете дело с электролитическим элементом, который использует электрическую энергию для принудительного химического изменения.
- Если вы описываете общую область или устройство с двойными возможностями (например, перезаряжаемый аккумулятор): Термин «электрохимическая ячейка» является правильным и наиболее полным выбором.
Понимание направления преобразования энергии — ключ к освоению этой фундаментальной концепции в химии и технике.
Сводная Таблица:
| Характеристика | Гальванический (Вольтов) Элемент | Электролитический Элемент |
|---|---|---|
| Преобразование Энергии | Химическая → Электрическая | Электрическая → Химическая |
| Тип Реакции | Спонтанная | Неспонтанная (принудительная) |
| Источник Питания | Автономный (например, батарея) | Требует внешнего источника питания |
| Полярность Анода | Отрицательный (-) вывод | Положительный (+) вывод |
| Распространенный Пример | Батарейка АА в пульте | Перезарядка литий-ионного аккумулятора |
Нужен точный контроль химических реакций в вашей лаборатории? Понимание правильного типа электрохимической ячейки имеет решающее значение для ваших исследований и процессов. В KINTEK мы специализируемся на предоставлении высококачественного лабораторного оборудования и расходных материалов, адаптированных к вашим конкретным электрохимическим потребностям. Независимо от того, работаете ли вы с гальваническими элементами для выработки энергии или с электролитическими элементами для синтеза, наши решения обеспечивают точность и надежность. Свяжитесь с нами сегодня, чтобы обсудить, как мы можем поддержать успех вашей лаборатории!
Визуальное руководство
Связанные товары
- Двухслойная оптическая электролитическая электрохимическая ячейка H-типа с водяной баней
- Электрохимическая ячейка для оценки покрытий
- Кварцевая электрохимическая ячейка для электрохимических экспериментов
- Электролитическая ячейка H-типа Тройная электрохимическая ячейка
- Электрохимическая ячейка из ПТФЭ, коррозионностойкая, герметичная и негерметичная
Люди также спрашивают
- Как следует хранить электролитическую ячейку H-типа, когда она не используется? Руководство эксперта по хранению и обслуживанию
- Что такое H-образная ячейка? Руководство по разделенным электрохимическим ячейкам для точных экспериментов
- Какова структура электролитической ячейки с обменной мембраной H-типа? Руководство по точному электрохимическому разделению
- Каковы ключевые особенности двухслойной электролитической ячейки с водяной баней? Обеспечьте точный контроль температуры для ваших экспериментов
- Каково назначение двухслойной конструкции электролитической ячейки H-типа? Обеспечение точного контроля температуры



















