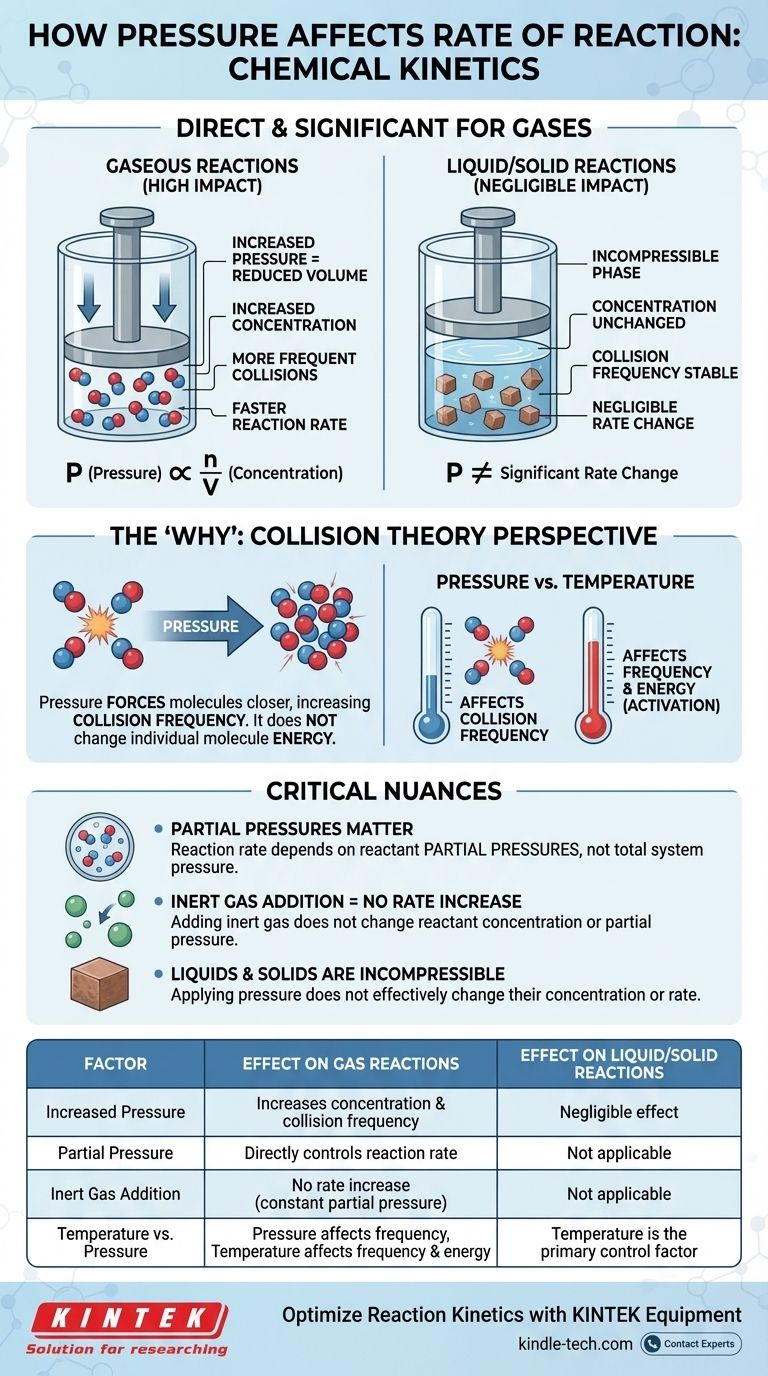
В химической кинетике влияние давления на скорость реакции является прямым и значительным, но только для реакций с участием газов. Для газовой реакции увеличение давления увеличивает концентрацию молекул реагентов. Это приводит к более частым столкновениям между ними, что, в свою очередь, увеличивает общую скорость реакции. Для реакций, происходящих исключительно в жидкой или твердой фазах, давление оказывает незначительное влияние на скорость.
Связь между давлением и скоростью реакции — это, по сути, история о концентрации. Для газов увеличение давления — это просто физический способ заставить больше молекул находиться в том же объеме, увеличивая частоту эффективных столкновений и, таким образом, ускоряя реакцию.

Фундаментальная связь: Давление как показатель концентрации
Основная причина, по которой давление влияет на газовые реакции, заключается в его прямой связи с концентрацией. Этот принцип лучше всего объясняется, если рассмотреть основополагающие законы химии.
Роль идеального газового закона
Идеальный газовый закон, PV = nRT, обеспечивает математическую связь. Если мы перестроим его для решения относительно давления (P = (n/V)RT), мы увидим, что давление (P) прямо пропорционально n/V.
Термин n/V представляет собой моли (n) на единицу объема (V), что является самим определением молярной концентрации. Следовательно, при увеличении давления системы при постоянной температуре вы напрямую увеличиваете концентрацию молекул газа в ней.
Как концентрация регулирует скорость реакции
Скорость реакции определяется ее законом скорости, часто выражаемым как rate = k[A]^m[B]^n. В этом уравнении [A] и [B] представляют концентрации реагентов.
Закон скорости показывает, что скорость реакции напрямую зависит от концентрации ее реагентов. Более высокая концентрация означает более высокую скорость. Связывая это с газовым законом, цепочка событий становится ясной: увеличение давления увеличивает концентрацию, что, в свою очередь, увеличивает скорость реакции.
Причина изменения: Перспектива теории столкновений
Законы скорости говорят нам, что происходит, но теория столкновений объясняет, почему это происходит на молекулярном уровне. Чтобы реакция произошла, частицы реагентов должны столкнуться с достаточной энергией и правильной ориентацией.
Принцип частоты столкновений
Химическая реакция является результатом бесчисленных молекулярных столкновений. Чем больше столкновений происходит в секунду, тем больше возможностей для успешной реакции.
Как давление увеличивает количество столкновений
Увеличение давления на газ уменьшает занимаемый им объем, заставляя молекулы сближаться. Это резко увеличивает их частоту столкновений — количество раз, когда они сталкиваются друг с другом в единицу времени.
Хотя давление не изменяет энергию отдельных молекул (это роль температуры), оно умножает общее количество событий столкновений. Это увеличение частоты приводит к пропорциональному увеличению успешных, вызывающих реакцию столкновений.
Понимание нюансов и компромиссов
Хотя общее правило сохраняется, эксперт должен понимать конкретные условия, при которых оно применяется, и, что более важно, когда оно не применяется.
Критическая роль парциальных давлений
В смеси газов общая скорость реакции зависит от парциальных давлений конкретных реагентов, а не от общего давления системы. Парциальное давление — это давление, которое один газ оказывал бы, если бы он один занимал весь объем.
Это означает, что вы можете увеличить общее давление, добавив инертный газ (например, аргон или азот) в реакционный сосуд. Однако, поскольку это не изменяет концентрацию или парциальное давление фактических реагентов, это не увеличит скорость реакции.
Незначительное влияние на жидкости и твердые вещества
Давление оказывает незначительное влияние на скорость реакции в конденсированных фазах (жидкостях и твердых веществах). Эти состояния вещества уже считаются несжимаемыми.
Молекулы в жидкостях и твердых веществах уже плотно упакованы. Приложение внешнего давления не приводит к значительному уменьшению расстояния между ними или изменению их концентрации. Следовательно, это неэффективный рычаг для изменения скорости их реакций.
Давление против температуры
Крайне важно различать влияние давления и температуры.
- Давление в основном влияет на частоту столкновений.
- Температура влияет как на частоту столкновений (молекулы движутся быстрее), так и, что более важно, на энергию каждого столкновения.
Повышение температуры увеличивает долю молекул, обладающих минимально необходимой энергией активации, что делает ее гораздо более мощным фактором для увеличения скорости реакции, чем давление.
Правильный выбор для вашей системы
Понимание этого принципа позволяет вам контролировать результаты реакции в соответствии с вашими конкретными целями. Учитывайте следующее при проектировании или оптимизации химического процесса.
- Если ваша основная цель — максимизировать скорость газовой реакции: Увеличение давления в системе путем уменьшения ее объема является прямым и эффективным методом увеличения производительности.
- Если ваша основная цель — контролировать реакцию в газовой смеси: Вы должны управлять парциальными давлениями реагентов, так как простое добавление инертного газа для повышения общего давления не ускорит вашу целевую реакцию.
- Если ваша основная цель — изменить скорость реакции в жидкости или твердом теле: Манипулирование давлением не является жизнеспособной стратегией; вам следует сосредоточиться на изменении температуры, концентрации растворенных веществ или использовании катализатора.
Понимая, что давление является показателем концентрации в газах, вы получаете точный контроль над кинетикой вашей системы.
Сводная таблица:
| Фактор | Влияние на газовые реакции | Влияние на реакции в жидкостях/твердых телах |
|---|---|---|
| Повышенное давление | Увеличивает концентрацию и частоту столкновений | Незначительное влияние (несжимаемые) |
| Парциальное давление | Напрямую контролирует скорость реакции | Неприменимо |
| Добавление инертного газа | Отсутствие увеличения скорости (постоянное парциальное давление) | Неприменимо |
| Температура против давления | Давление влияет на частоту; Температура влияет на частоту и энергию | Температура является основным фактором контроля |
Нужен точный контроль над вашими химическими реакциями? KINTEK специализируется на высококачественном лабораторном оборудовании, включая реакторы высокого давления и системы для работы с газами, чтобы помочь вам оптимизировать кинетику реакции и достичь превосходных результатов в вашей лаборатории. Свяжитесь с нашими экспертами сегодня, чтобы обсудить ваше конкретное применение и найти правильное решение для ваших нужд.
Визуальное руководство
Связанные товары
- Настраиваемые реакторы высокого давления для передовых научных и промышленных применений
- Миниавтоклав высокого давления из нержавеющей стали для лабораторного использования
- Реактор высокого давления из нержавеющей стали, лабораторный реактор высокого давления
- Автоклавный реактор для гидротермального синтеза высокого давления
- Электрический лабораторный изостатический пресс с раздельной конструкцией для холодного изостатического прессования
Люди также спрашивают
- Почему системы термического каталитического производства водорода требуют высокоточного нагрева? Обеспечение чистоты и безопасности реактора
- Почему для синтеза цеолита на основе золы-уноса необходим лабораторный реактор высокого давления? Достижение чистой кристаллизации
- Какие технические характеристики требуются для реакторов высокого давления? Экспертное проектирование для успешной ГВЛ биомассы
- Что такое автоклав высокого давления? Полное руководство по высокотемпературным, высоконапорным реакторам
- Какова роль реактора высокого давления в подготовке МОФ и КОФ? Оптимизируйте синтез передовых материалов
- Какова функция реактора высокого давления и температуры? Оптимизация синтеза Fe3O4 для адсорбентов бора
- Какую функцию выполняют перегородки внутри реактора? Повышение эффективности переработки задних пленок фотоэлектрических модулей
- Каково значение реактора с неподвижным слоем из нержавеющей стали? Повышение эффективности крекинга и дезоксигенации пальмового масла



















