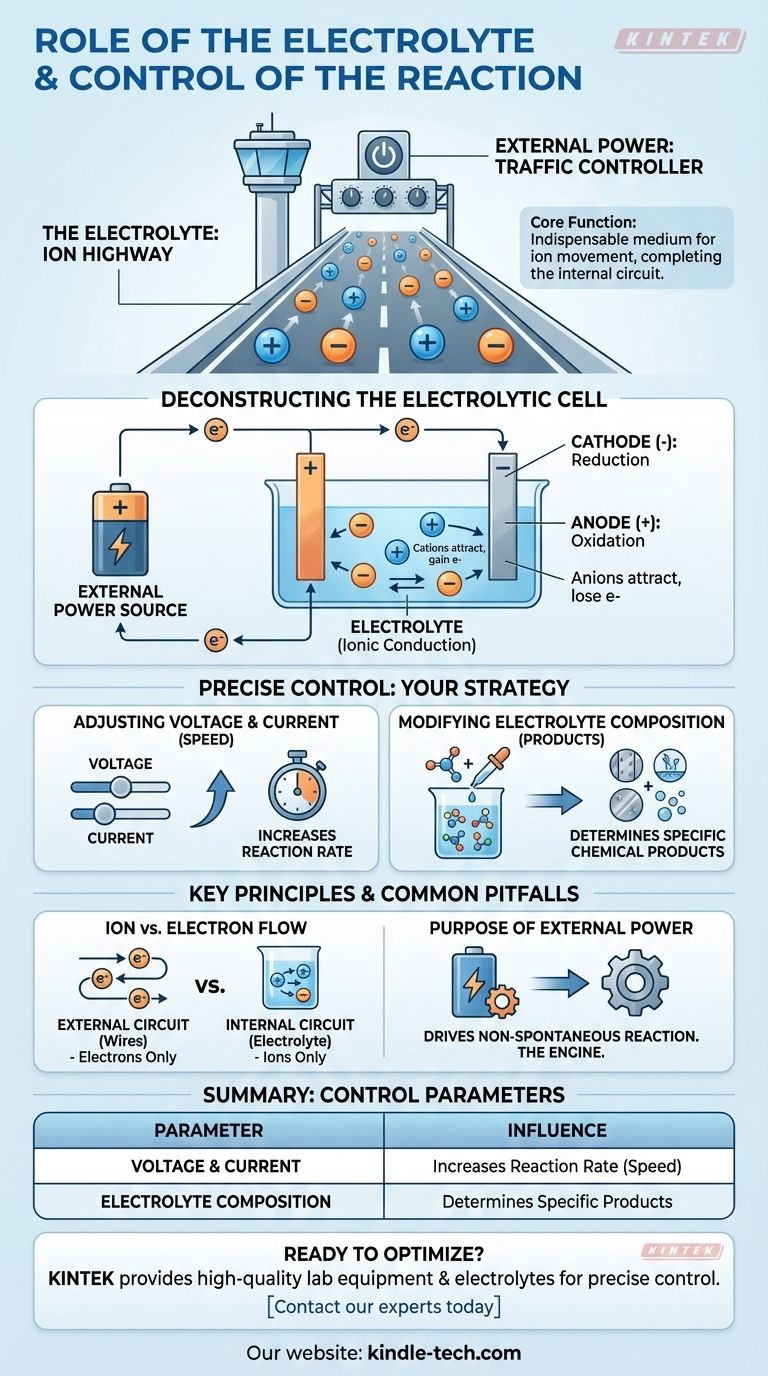
По своей сути, электролит является незаменимой средой для движения ионов внутри ячейки, завершающей электрическую цепь, которая позволяет протекать химической реакции. Сама реакция точно контролируется путем манипулирования внешними электрическими входами — в частности, напряжением и током — и путем изменения химического состава электролитного раствора.
Электролит действует как «ионное шоссе», позволяя заряженным частицам перемещаться между электродами внутри ячейки. Внешний источник питания действует как «регулировщик движения», диктуя скорость и направление химической реакции путем управления потоком электронов.

Фундаментальная роль электролита
Электрохимическая реакция требует замкнутой цепи. Электролит отвечает за внутреннюю половину этой цепи, роль, которая принципиально отличается от роли внешних проводов.
Что такое электролит?
Электролит — это раствор, обычно водный или органический, содержащий диссоциированные ионы.
Именно эти свободно плавающие положительные и отрицательные ионы делают раствор электропроводным.
Обеспечение ионной проводимости
Основная функция электролита — ионная проводимость.
В то время как электроны текут по внешним проводам, ионы должны течь через раствор между двумя электродами. Это движение заряженных ионов завершает цепь, позволяя реакции поддерживаться.
Разборка электролитической ячейки
В электролитической ячейке внешний источник питания вызывает химическую реакцию, которая сама по себе не произошла бы. Вот как компоненты работают вместе.
Внешний источник питания
Процесс начинается с внешнего источника питания, такого как батарея или блок питания.
Этот источник активно перекачивает электроны, создавая разность зарядов между двумя электродами, которая заставляет реакцию продолжаться.
Катод (место восстановления)
Внешний источник подает электроны на катод, придавая ему отрицательный заряд.
Этот отрицательный заряд притягивает положительно заряженные ионы (катионы) из электролита. Когда эти ионы достигают катода, они принимают электроны в процессе, называемом восстановлением.
Анод (место окисления)
Одновременно внешний источник отводит электроны от анода, придавая ему положительный заряд.
Этот положительный заряд притягивает отрицательно заряженные ионы (анионы) из электролита. На аноде эти ионы теряют электроны в процессе, известном как окисление.
Как точно контролируется реакция
Вы имеете прямой контроль над исходом и скоростью электрохимической реакции, регулируя три ключевых параметра.
Регулировка напряжения и тока
Напряжение можно рассматривать как электрическое «давление», движущее реакцию, в то время как ток — это скорость потока электронов.
Увеличение напряжения и тока, как правило, увеличивает скорость, с которой происходит химическая реакция. Это дает вам прямой, оперативный контроль над скоростью процесса.
Изменение состава электролита
Конкретная химическая реакция, которая происходит, определяется ионами, присутствующими в электролите.
Изменяя состав электролита — например, используя другую соль или растворитель — вы можете изменить продукты, образующиеся на аноде и катоде.
Распространенные ошибки и ключевые принципы
Чтобы по-настоящему понять систему, крайне важно различать две половины цепи и природу ячейки.
Движение ионов против потока электронов
Распространенное заблуждение — это разница между тем, что происходит внутри ячейки и снаружи нее.
Электроны текут только через внешнюю цепь (провода). Ионы текут только через внутреннюю цепь (электролит). Реакция на поверхностях электродов соединяет эти два разных пути.
Назначение внешнего питания
Важно помнить, что этот процесс описывает электролитическую ячейку.
В этих ячейках электрическая энергия используется для вызова несамопроизвольной химической реакции. Внешний источник питания не является необязательным; это двигатель, делающий весь процесс возможным.
Сделайте правильный выбор для вашей цели
Ваша стратегия контроля полностью зависит от того, чего вы хотите достичь с помощью реакции.
- Если ваша основная цель — ускорить скорость реакции: Увеличьте приложенное напряжение и ток, чтобы быстрее стимулировать поток электронов и ионов.
- Если ваша основная цель — создать определенный химический продукт: Тщательно выберите и контролируйте состав электролита, чтобы обеспечить наличие желаемых ионов для реакции.
- Если ваша основная цель — понять эффективность системы: Вы должны отслеживать как поток электронов (ток) во внешней цепи, так и возникающее химическое изменение (превращение ионов) на электродах.
В конечном счете, овладение электрохимическим процессом означает понимание того, что электролит и внешняя цепь — это две половины единой, контролируемой системы.
Сводная таблица:
| Параметр управления | Как это влияет на реакцию |
|---|---|
| Напряжение и ток | Увеличивает скорость химической реакции. |
| Состав электролита | Определяет конкретные образующиеся химические продукты. |
Готовы оптимизировать свой электрохимический процесс?
Независимо от того, разрабатываете ли вы новые материалы, выполняете гальванотехнику или проводите точные аналитические тесты, контроль вашей электрохимической реакции имеет решающее значение. KINTEK специализируется на предоставлении высококачественного лабораторного оборудования и расходных материалов для всех ваших лабораторных нужд, включая надежные источники питания и чистые электролиты.
Свяжитесь с нашими экспертами сегодня, чтобы обсудить, как мы можем помочь вам достичь точного контроля и превосходных результатов в вашей лаборатории.
Визуальное руководство
Связанные товары
- Двухслойная оптическая электролитическая электрохимическая ячейка H-типа с водяной баней
- Электролитическая ячейка H-типа Тройная электрохимическая ячейка
- Двухслойная пятипортовая электрохимическая ячейка с водяной баней
- Кварцевая электрохимическая ячейка для электрохимических экспериментов
- Электрохимическая ячейка для оценки покрытий
Люди также спрашивают
- Как следует хранить электролитическую ячейку H-типа, когда она не используется? Руководство эксперта по хранению и обслуживанию
- Какие оптические особенности имеет электрохимическая ячейка H-типа? Прецизионные кварцевые окна для фотоэлектрохимии
- Какова структура электролитической ячейки с обменной мембраной H-типа? Руководство по точному электрохимическому разделению
- Какая типичная экспериментальная система используется с двухслойной электролитической ячейкой с водяной баней? Достижение точного электрохимического контроля
- Что такое H-образная ячейка? Руководство по разделенным электрохимическим ячейкам для точных экспериментов



















