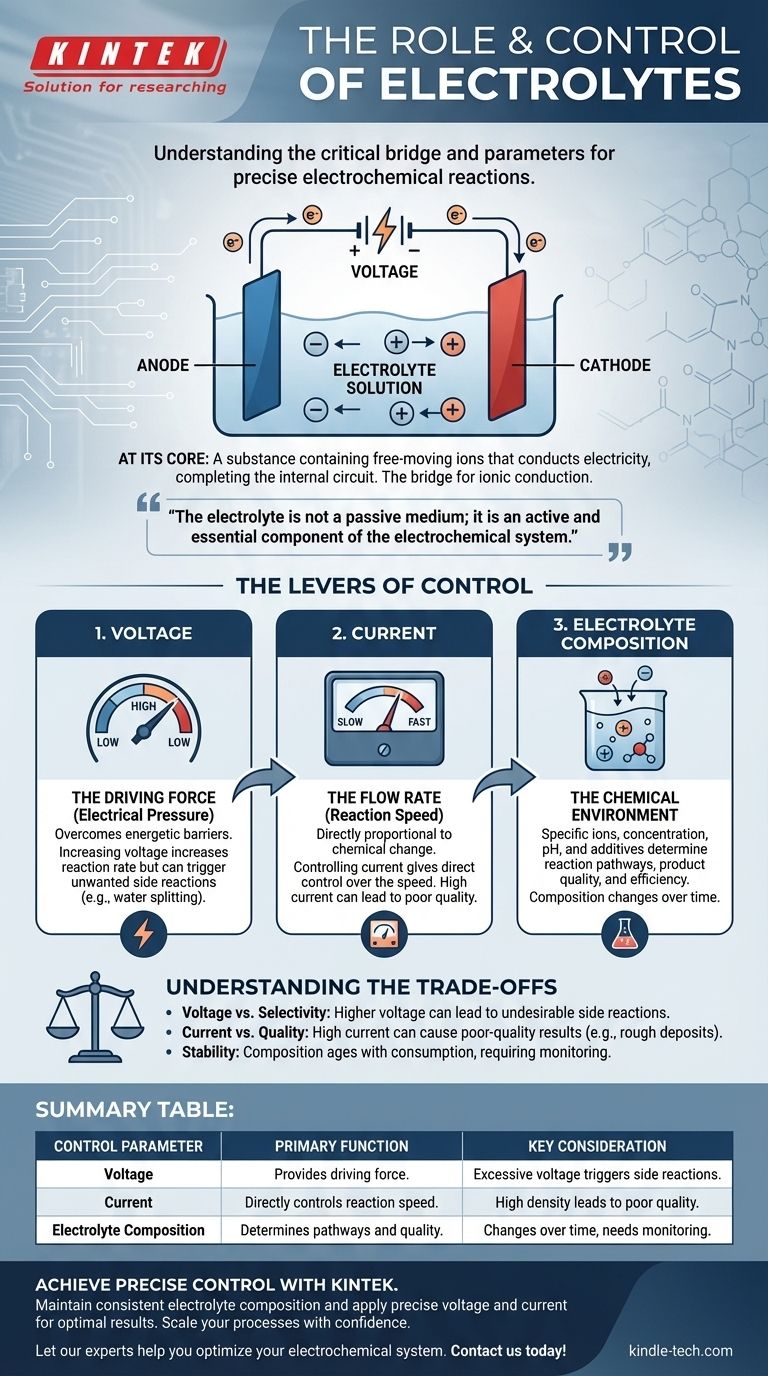
По своей сути, электролит — это вещество, содержащее свободноподвижные ионы, которое проводит электричество, замыкая цепь внутри электрохимической ячейки. Это критически важный мост, который позволяет химической реакции протекать под действием внешнего источника питания. Сама реакция точно контролируется путем регулировки трех ключевых параметров: приложенного напряжения, результирующего тока и химического состава электролита.
Электролит — это не пассивная среда; это активный и неотъемлемый компонент электрохимической системы. Понимание того, как манипулировать электрическими входами и химией электролита, является ключом к превращению реакции из грубого процесса в точно контролируемую операцию.

Основная роль электролита
Чтобы контролировать систему, вы должны сначала понять ее не подлежащие обсуждению компоненты. В электрохимии электролит является внутренним путем, который делает весь процесс возможным.
Что такое электролит?
Электролит, как правило, представляет собой раствор, содержащий растворенные соли, кислоты или основания, которые диссоциируют на положительно заряженные катионы и отрицательно заряженные анионы. Хотя часто это водный (на водной основе) раствор, они также могут быть основаны на органических растворителях или даже существовать в виде расплавленных солей при высоких температурах.
Ключевым свойством является наличие подвижных ионов. Без них внутренняя цепь разрывается, и электрохимическая реакция не может произойти.
Мост для ионной проводимости
Электрохимическая ячейка имеет две цепи. Внешняя цепь — это проводка, по которой электроны перемещаются от одного электрода к другому.
Внутренняя цепь — это электролит. Когда электроны прибывают к одному электроду (катоду) и уходят от другого (анода), ионы должны перемещаться через электролит для балансировки заряда. Катионы движутся к катоду, а анионы движутся к аноду, замыкая электрическую цепь.
Больше, чем просто проводник
Электролит также активно участвует в реакции. Его состав определяет, какие химические вещества доступны для окисления или восстановления, какими будут продукты реакции и как быстро может протекать реакция.
Рычаги управления: как управлять реакцией
Контроль электрохимической реакции означает управление скоростью и исходом химических изменений, происходящих на электродах. Это достигается путем управления электрическими и химическими свойствами системы.
Управление напряжением (движущая сила)
Напряжение можно рассматривать как «электрическое давление», подталкивающее реакцию вперед. Для преодоления энергетического барьера определенной реакции требуется определенное минимальное напряжение.
Увеличение напряжения, как правило, увеличивает скорость реакции. Однако применение чрезмерного напряжения — это грубый инструмент, который может вызвать нежелательные побочные реакции.
Управление током (скорость потока)
Ток — это мера того, сколько электронов протекает через цепь за единицу времени. Согласно законам электролиза Фарадея, количество химического изменения прямо пропорционально количеству прошедшего заряда.
Следовательно, контроль тока дает вам прямой контроль над скоростью реакции. Постоянный ток (гальваностатический контроль) гарантирует, что реакция протекает с постоянной, предсказуемой скоростью.
Регулировка состава электролита (химическая среда)
Это самый тонкий уровень контроля. Конкретные ионы, их концентрация, растворитель и любые добавки фундаментально изменяют среду реакции.
Ключевые факторы включают концентрацию (которая влияет на проводимость и доступность ионов), pH (который может определять, какие реакции возможны в воде) и наличие специализированных добавок, которые могут ингибировать коррозию, осветлять гальваническое покрытие или иным образом изменять результат.
Понимание компромиссов
Точный контроль требует осведомленности об ограничениях и последствиях каждой корректировки. Чрезмерное усиление одного параметра часто компрометирует другой.
Проблема напряжения против селективности
Хотя более высокое напряжение увеличивает скорость, оно также может обеспечить достаточно энергии для инициирования нежелательных реакций. Например, в водном растворе чрезмерное напряжение может начать расщеплять воду на водород и кислород, потребляя энергию и снижая эффективность вашей основной цели.
Плотность тока и качество
Стремление к очень высокому току (и, следовательно, к высокой скорости реакции) может привести к низкому качеству результатов. В гальванике слишком высокий ток может привести к истощению ионов у поверхности электрода, что приведет к получению грубого, пористого или «сгоревшего» осадка. Качество часто требует терпения и более низкой плотности тока.
Стабильность и срок службы электролита
Электролит не является статичным. Его состав изменяется в ходе реакции по мере расходования ионов и попадания загрязнителей. Растворители могут испаряться, а добавки могут израсходоваться. Это «старение» электролита является основным источником непостоянства в длительных промышленных процессах и требует мониторинга и обслуживания.
Сделайте правильный выбор для вашей цели
Ваша стратегия контроля полностью зависит от того, чего вы хотите достичь. Используйте эти принципы для руководства вашим подходом.
- Если ваш основной фокус — максимальная скорость реакции: Используйте более высокий ток и убедитесь, что концентрация электролита достаточно высока, чтобы поддерживать эту скорость без значительного истощения ионов у электродов.
- Если ваш основной фокус — достижение высокой точности или качества: Используйте более низкую, тщательно контролируемую плотность тока или приложите определенное напряжение (потенциостатический контроль), чтобы реакция протекала плавно и селективно.
- Если ваш основной фокус — устранение непостоянства процесса: Начните с анализа электролита. Его состав, концентрация и потенциальное загрязнение являются наиболее распространенными источниками изменчивости процесса.
Освоение этих принципов превращает электрохимический процесс из «черного ящика» в точно настраиваемую систему.
Сводная таблица:
| Параметр управления | Основная функция | Ключевое соображение |
|---|---|---|
| Напряжение | Обеспечивает движущую силу для реакции. | Чрезмерное напряжение может вызвать нежелательные побочные реакции. |
| Ток | Непосредственно контролирует скорость реакции. | Высокая плотность тока может привести к низкому качеству результатов. |
| Состав электролита | Определяет пути реакции и качество продукта. | Состав со временем меняется, что требует мониторинга. |
Готовы добиться точного контроля над вашими электрохимическими процессами?
В KINTEK мы специализируемся на предоставлении высококачественного лабораторного оборудования и расходных материалов, необходимых для освоения ваших реакций. Независимо от того, разрабатываете ли вы новые материалы, занимаетесь гальваникой или проводите исследования, наши решения помогут вам:
- Поддерживать стабильный состав электролита для надежных результатов.
- Применять точный контроль напряжения и тока для оптимальной селективности и качества.
- С уверенностью масштабировать свои процессы от лабораторного стола до производства.
Позвольте нашим экспертам помочь вам оптимизировать вашу электрохимическую систему. Свяжитесь с нами сегодня, чтобы обсудить ваше конкретное применение и проблемы!
Визуальное руководство
Связанные товары
- Электрохимическая ячейка с газодиффузионным электролизом и ячейка для реакции с протоком жидкости
- Двухслойная оптическая электролитическая электрохимическая ячейка H-типа с водяной баней
- Кварцевая электрохимическая ячейка для электрохимических экспериментов
- Электрохимическая ячейка из ПТФЭ, коррозионностойкая, герметичная и негерметичная
- Электрохимическая ячейка для оценки покрытий
Люди также спрашивают
- Каковы преимущества использования резервуара для осаждения из ПТФЭ для ЭОД? Достигните непревзойденной точности покрытия на нержавеющей стали
- Какая мера предосторожности относительно температуры при использовании электролитической ячейки из чистого ПТФЭ? Основные советы по тепловой безопасности
- Какие параметры должны строго контролироваться при использовании электролитической ячейки из ПТФЭ? Обеспечение точности и безопасности
- Какие преимущества проточных электролитических ячеек по сравнению с ячейками H-типа? Оптимизация эффективности электролиза CO2
- Какова цель использования стеклянной трубки с фриттой в трехэлектродной ячейке? Повышение точности тестирования ванадиевых редокс-систем



















