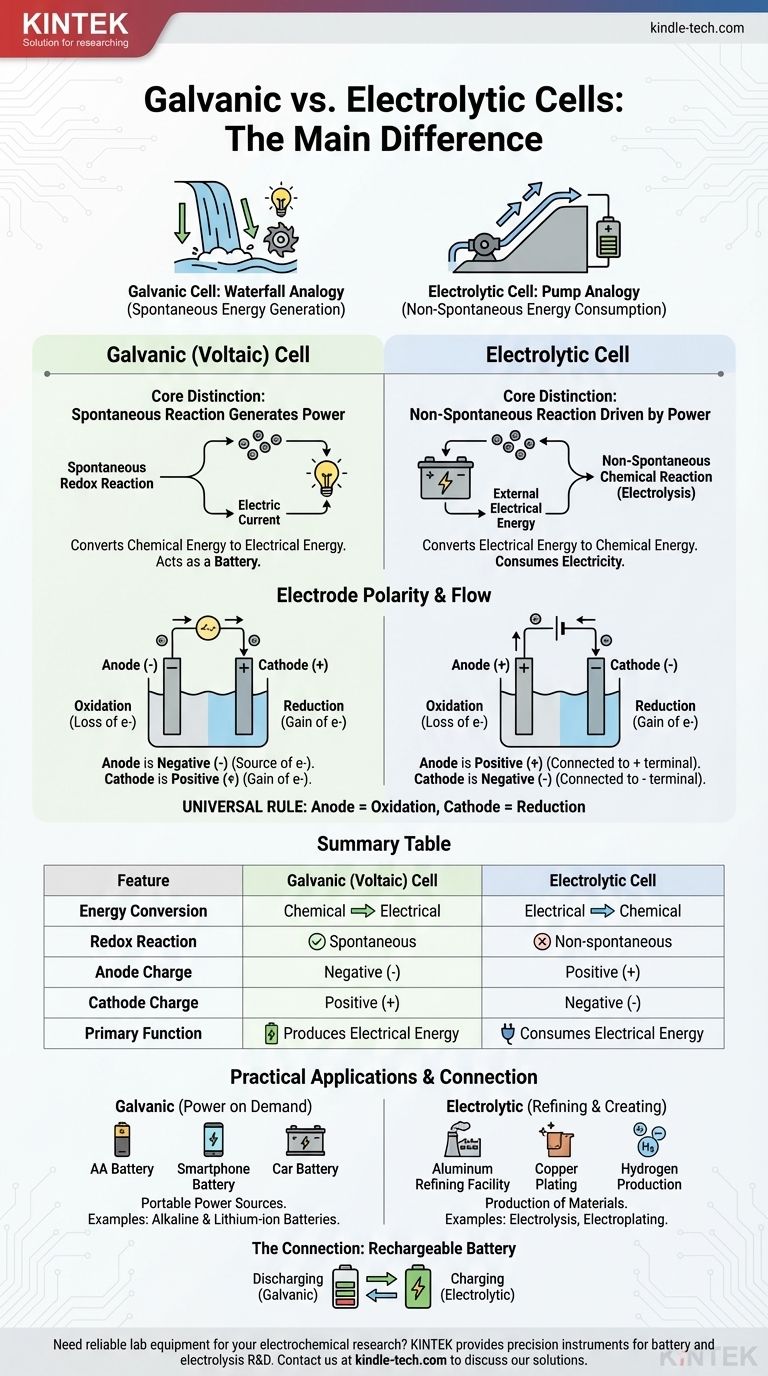
Фундаментальное различие заключается в направлении преобразования энергии и природе химической реакции. Гальванический элемент спонтанно преобразует запасенную химическую энергию в электрическую, фактически действуя как батарея. В отличие от этого, электролитический элемент использует внешний источник электрической энергии для принудительного протекания несамопроизвольной химической реакции.
Представьте это как разницу между водопадом, генерирующим энергию, и насосом, потребляющим энергию. Гальванический элемент подобен водопаду, где естественный, спонтанный процесс (течение воды вниз) создает энергию. Электролитический элемент подобен насосу, использующему внешнюю энергию для принудительного процесса, который сам по себе не произошел бы (подъем воды в гору).

Основное различие: спонтанность и поток энергии
Поведение этих двух элементов регулируется одним принципом: происходит ли внутренняя окислительно-восстановительная реакция сама по себе.
Гальванические элементы: спонтанные реакции, генерирующие энергию
В гальваническом элементе, также известном как вольтов элемент, выбранные химические реагенты имеют естественную тенденцию реагировать друг с другом.
Эта спонтанная окислительно-восстановительная реакция высвобождает энергию. Элемент сконструирован таким образом, чтобы направлять эту энергию не в виде тепла, а в виде направленного потока электронов — электрического тока.
По сути, гальванический элемент использует естественно протекающий химический процесс для выполнения электрической работы. Это принцип, лежащий в основе всех батарей.
Электролитические элементы: несамопроизвольные реакции, вызванные энергией
В электролитическом элементе химическая реакция является несамопроизвольной. Реагенты не будут взаимодействовать сами по себе для получения желаемых продуктов.
Чтобы реакция произошла, к элементу подключается внешний источник питания (например, батарея или блок питания). Это внешнее напряжение обеспечивает энергию, необходимую для принудительного движения электронов и запуска химического изменения.
Электролитические элементы потребляют электричество для создания химического продукта, процесс, известный как электролиз.
Более глубокий взгляд на полярность электродов
Хотя термины «анод» и «катод» постоянны, их заряд (полярность) часто вызывает путаницу, поскольку он меняется местами между двумя типами элементов. Ключевым моментом является запоминание того, что движет потоком электронов.
Анод: всегда место окисления
В обоих типах элементов анод определяется как электрод, где происходит окисление (потеря электронов). Это определение универсально.
Катод: всегда место восстановления
Аналогично, катод всегда является электродом, где происходит восстановление (приобретение электронов). Это второе универсальное правило.
Критический сдвиг: почему меняется полярность
Разница в полярности проистекает из того, является ли реакция спонтанной или принудительной.
В гальваническом элементе спонтанное окисление на аноде высвобождает электроны, создавая отрицательный заряд. Анод является отрицательной клеммой, потому что он является источником электронов, выталкиваемых в цепь.
В электролитическом элементе используется внешний источник питания. Его положительная клемма оттягивает электроны от анода, чтобы вызвать окисление. Следовательно, анод подключается к положительной стороне и становится положительной клеммой.
| Характеристика | Гальванический (вольтов) элемент | Электролитический элемент |
|---|---|---|
| Преобразование энергии | Химическая в электрическую | Электрическая в химическую |
| Окислительно-восстановительная реакция | Спонтанная | Несамопроизвольная |
| Заряд анода | Отрицательный (-) | Положительный (+) |
| Заряд катода | Положительный (+) | Отрицательный (-) |
| Основная функция | Производит электрическую энергию | Потребляет электрическую энергию |
Понимание практического применения
Это фундаментальное различие приводит к различным применениям в технологиях и промышленности.
Гальванические элементы в действии: энергия по требованию
Гальванические элементы предназначены для использования в качестве портативных источников электрической энергии. Распространенные примеры включают все типы батарей, от стандартных щелочных батареек АА до литий-ионных батарей в вашем телефоне.
Электролитические элементы в работе: очистка и создание
Электролитические элементы используют энергию для производства материалов. Ключевые промышленные процессы основаны на электролизе, такие как производство чистого алюминия из руды, рафинирование меди и расщепление воды для получения водорода и кислорода. Гальваностегия, при которой тонкий слой металла, такого как серебро или хром, наносится на другой объект, является еще одним распространенным применением.
Связь: как работает перезаряжаемая батарея
Перезаряжаемая батарея — идеальная иллюстрация обоих типов элементов в одном устройстве.
Когда она питает ваше устройство (разряжается), она работает как гальванический элемент. Спонтанная химическая реакция внутри батареи производит электрический ток.
Когда вы подключаете ее для зарядки, зарядное устройство действует как внешний источник питания. Оно подает напряжение, которое вызывает несамопроизвольную, обратную реакцию, пополняя реагенты. Во время зарядки батарея функционирует как электролитический элемент.
Правильный выбор для вашей цели
Ваша цель определяет, какую электрохимическую систему вы используете.
- Если ваша основная цель — генерация электричества из химического процесса: Вы описываете гальванический (вольтов) элемент.
- Если ваша основная цель — использование электричества для запуска определенного химического изменения: Вы работаете с электролитическим элементом.
- Если вы анализируете перезаряжаемую батарею: Помните, что она работает как гальванический элемент при разрядке и как электролитический элемент при перезарядке.
В конечном итоге, спонтанность реакции и результирующее направление потока энергии являются определяющими характеристиками, которые разделяют эти два столпа электрохимии.
Сводная таблица:
| Характеристика | Гальванический (вольтов) элемент | Электролитический элемент |
|---|---|---|
| Преобразование энергии | Химическая в электрическую | Электрическая в химическую |
| Окислительно-восстановительная реакция | Спонтанная | Несамопроизвольная |
| Заряд анода | Отрицательный (-) | Положительный (+) |
| Заряд катода | Положительный (+) | Отрицательный (-) |
| Основная функция | Производит электрическую энергию | Потребляет электрическую энергию |
Нужно надежное лабораторное оборудование для ваших электрохимических исследований? Разрабатываете ли вы новые аккумуляторные технологии или оптимизируете процессы электролиза, KINTEK предоставляет точные приборы и расходные материалы, необходимые вашей лаборатории. Свяжитесь с нами сегодня, чтобы обсудить, как наши решения могут способствовать вашим инновациям!
Визуальное руководство
Связанные товары
- Электрохимическая ячейка для оценки покрытий
- Электрохимическая ячейка с пятью портами
- Двухслойная оптическая электролитическая электрохимическая ячейка H-типа с водяной баней
- Электрохимическая ячейка с газодиффузионным электролизом и ячейка для реакции с протоком жидкости
- Многофункциональная электролитическая ячейка с водяной баней, однослойная, двухслойная
Люди также спрашивают
- Как используется высокоточная электролитическая ячейка для оценки коррозионной стойкости металлов? Точная проверка результатов DCT
- Каков принцип работы электрохимической ячейки для коррозионных испытаний на плоской пластине? Руководство по контролируемому испытанию материалов
- Как трехэлектродная электрохимическая ячейка используется для оценки коррозионной стойкости сплава Zr-Nb?
- Как работает трехэлектродная электролитическая ячейка? Прецизионные испытания стали 8620 в коррозионных средах
- Как система электрохимической ячейки обеспечивает точность измерений при испытаниях двойным циклом электрохимической потенциокинетической реактивации (DL-EPR) супердуплексной нержавеющей стали?














