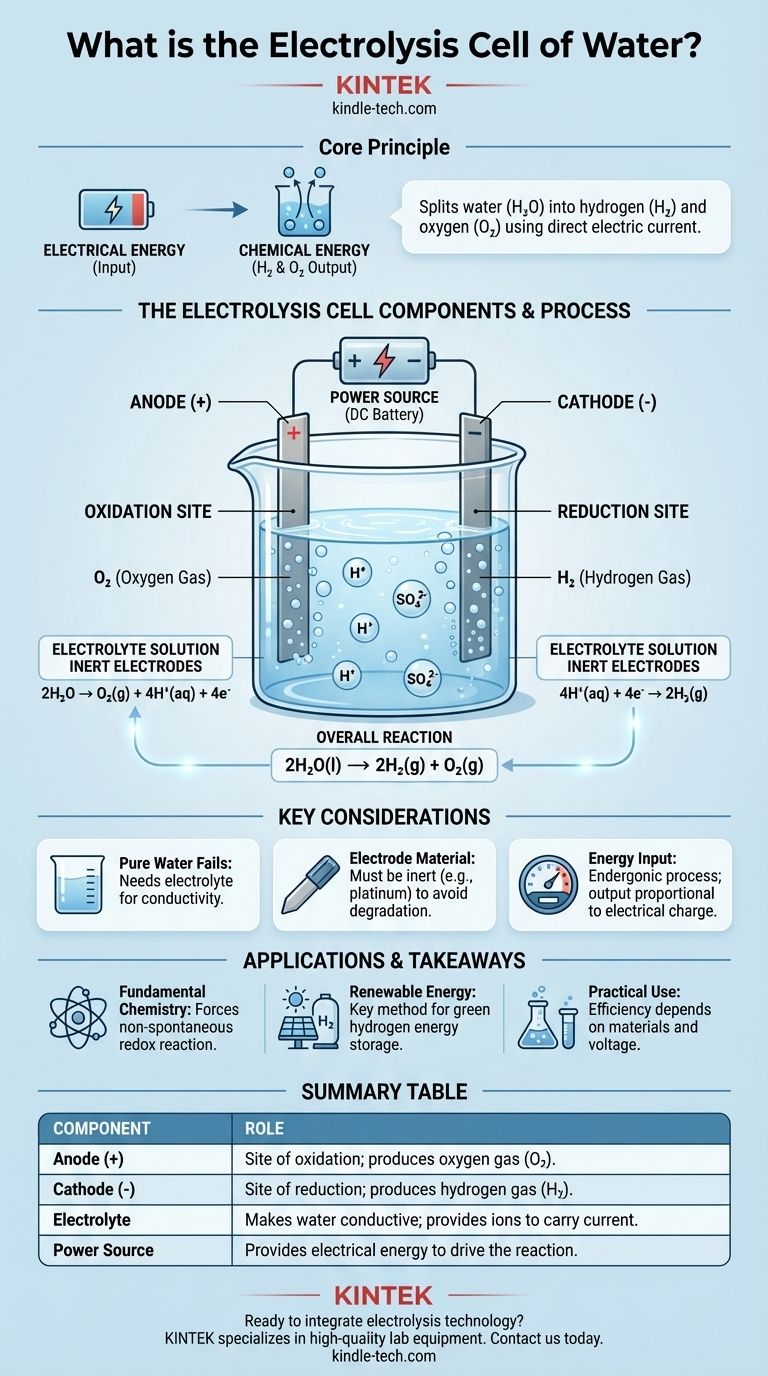
По своей сути, электролитическая ячейка для воды — это устройство, которое использует электрическую энергию для расщепления воды (H₂O) на ее составляющие элементы: газообразный водород (H₂) и газообразный кислород (O₂). Это достигается путем пропускания постоянного электрического тока через воду, содержащую небольшое количество электролита, что вызывает химическое изменение, которое не произошло бы само по себе. Основными компонентами являются два электрода (анод и катод), погруженные в электролит и подключенные к внешнему источнику питания.
Основная цель электролитической ячейки — преобразование электрической энергии в химическую. Она использует внешнее напряжение для запуска самопроизвольной окислительно-восстановительной реакции, эффективно запасая подводимую энергию в химических связях образующихся молекул водорода и кислорода.

Основные компоненты и их роли
Электролитическая ячейка для воды работает за счет точного взаимодействия трех ключевых частей: электродов, электролита и источника питания. Каждый из них играет отдельную и критически важную роль в этом процессе.
Электроды: Анод и Катод
Ячейка содержит два электрода, которые являются проводниками, через которые электричество входит в раствор и выходит из него. Обычно они изготавливаются из инертного материала, такого как платина или графит, чтобы гарантировать, что они способствуют реакции, не расходуясь при этом.
Анод — это положительный электрод. Это место окисления, где вещества теряют электроны.
Катод — это отрицательный электрод. Это место восстановления, где вещества приобретают электроны.
Электролит: Обеспечение проводимости воды
Чистая вода очень плохо проводит электричество, поскольку в ней слишком мало свободно движущихся ионов для эффективной передачи тока.
Чтобы решить эту проблему, добавляют небольшое количество электролита, например, серной кислоты (H₂SO₄). Электролит растворяется в воде и обеспечивает подвижные ионы (в данном случае H⁺ и SO₄²⁻), которые могут переносить заряд между электродами, замыкая электрическую цепь.
Источник питания: Запуск реакции
Расщепление воды является эндотермической реакцией, что означает, что для ее протекания требуется подведение энергии. Вода стабильна и не разлагается самопроизвольно.
Внешний источник питания, такой как батарея или источник постоянного тока, обеспечивает необходимое напряжение. Это электрическое давление «проталкивает» электроны в катод и «вытягивает» их из анода, заставляя протекать химическое разложение воды.
Химический процесс: Как расщепляется вода
Общий процесс представляет собой окислительно-восстановительную (редокс) реакцию, разделенную на две отдельные полуреакции, происходящие на каждом электроде.
Окисление на аноде (+)
На положительном аноде молекулы воды окисляются. Они отдают свои электроны, которые затем выходят из ячейки во внешнюю цепь.
Эта реакция производит газообразный кислород (O₂) и ионы водорода (H⁺). Полуреакция: 2H₂O → O₂(г) + 4H⁺(водн) + 4e⁻
Восстановление на катоде (-)
Ионы водорода (H⁺), образовавшиеся на аноде (и присутствующие из кислотного электролита), притягиваются к отрицательному катоду.
На катоде эти ионы принимают электроны, поступающие из внешней цепи. Эта реакция восстановления производит газообразный водород (H₂). Полуреакция: 4H⁺(водн) + 4e⁻ → 2H₂(г)
Общая реакция
Когда вы складываете две полуреакции, электроны и ионы водорода с обеих сторон сокращаются, раскрывая простой и наглядный общий результат электролиза воды.
Чистое химическое изменение: 2H₂O(ж) → 2H₂(г) + O₂(г). На каждые две расщепленные молекулы воды образуются две молекулы газообразного водорода и одна молекула газообразного кислорода.
Понимание ключевых аспектов
Хотя концепция проста, несколько факторов имеют решающее значение для правильной и эффективной работы ячейки. Понимание этих ограничений раскрывает истинную природу процесса.
Почему чистая вода не подходит
Без электролита сопротивление воды чрезвычайно велико. Приложение напряжения приведет к незначительному току и, следовательно, практически к нулевому образованию водорода или кислорода. Электролит не расходуется; его единственная задача — действовать как переносчик заряда.
Материал электрода имеет решающее значение
Использование инертных электродов, таких как платина, имеет важное значение. Если бы вы использовали реактивный металл, такой как цинк или медь, в качестве анода, сам анод окислялся бы и растворялся в растворе вместо воды. Это привело бы к образованию других, нежелательных продуктов и разрушению электрода.
Подводимая энергия определяет результат
Электролиз не является источником бесплатной энергии; это процесс преобразования энергии. Количество производимого водорода и кислорода прямо пропорционально количеству электрического заряда, пропущенного через ячейку. Для производства небольшого количества газообразного водорода требуется значительное количество электрической энергии.
Сделайте правильный выбор для вашей цели
Понимание электролитической ячейки полезно для различных дисциплин. Ваши выводы зависят от вашей основной цели.
- Если ваш основной фокус — фундаментальная химия: Рассматривайте это как прекрасную демонстрацию того, как электрическая энергия может заставить протекать самопроизвольную окислительно-восстановительную реакцию, разделяя стабильное соединение на его элементы.
- Если ваш основной фокус — возобновляемая энергия: Признайте электролиз ключевым методом накопления энергии, преобразующим избыточное электричество от таких источников, как солнечная или ветровая энергия, в водородное топливо.
- Если ваш основной фокус — практическое применение: Помните, что эффективность, скорость и продукты электролиза полностью зависят от используемых материалов — электролита, материала электрода и приложенного напряжения.
В конечном счете, электролиз воды — это мощный процесс, который использует электричество для высвобождения химической энергии, запасенной в простой молекуле.
Сводная таблица:
| Компонент | Роль в электролитической ячейке |
|---|---|
| Анод (Положительный электрод) | Место окисления; производит газообразный кислород (O₂). |
| Катод (Отрицательный электрод) | Место восстановления; производит газообразный водород (H₂). |
| Электролит | Обеспечивает проводимость воды; предоставляет ионы для переноса заряда. |
| Источник питания | Обеспечивает электрическую энергию для запуска самопроизвольной реакции. |
Готовы интегрировать технологию электролиза в свои лабораторные процессы? KINTEK специализируется на высококачественном лабораторном оборудовании и расходных материалах для передовых химических процессов. Независимо от того, разрабатываете ли вы новые решения для хранения энергии или проводите фундаментальные исследования, наш опыт гарантирует, что у вас будет надежное оборудование, которое вам нужно. Свяжитесь с нашей командой сегодня, чтобы обсудить, как мы можем поддержать ваши конкретные лабораторные требования.
Визуальное руководство
Связанные товары
- Двухслойная оптическая электролитическая электрохимическая ячейка H-типа с водяной баней
- Электрохимическая ячейка с пятью портами
- Двухслойная пятипортовая электрохимическая ячейка с водяной баней
- Электролитическая ячейка H-типа Тройная электрохимическая ячейка
- Электрохимическая ячейка с газодиффузионным электролизом и ячейка для реакции с протоком жидкости
Люди также спрашивают
- Как следует очищать многократно используемую электролитическую ячейку? Освойте 3-этапный протокол для получения надежных результатов
- Какова основная функция трехкамерного соединенного реактора? Освоение точности PEC и эффективности Фарадея
- Как можно контролировать производительность и состояние протонно-обменной мембраны? Руководство по здоровью и долговечности PEM
- Какое плановое техническое обслуживание двухслойной электролитической ячейки с водяной баней включает в себя? Руководство по обеспечению точности и долговечности
- Каковы компоненты и их соответствующие функции в системе электролитической ячейки для коррозии плоской пластины? Руководство по точному измерению коррозии
- Почему стеклянная реакционная ячейка из Pyrex предпочтительна для систем фотокаталитических реакций? Ключевые преимущества для лабораторий
- Что такое электролитическая ячейка и каковы ее основные применения? Разблокировка химических превращений с помощью электричества
- Каков надлежащий способ обращения с пятипортовой электролитической ячейкой с водяной баней? Обеспечение точных и безопасных электрохимических экспериментов



















