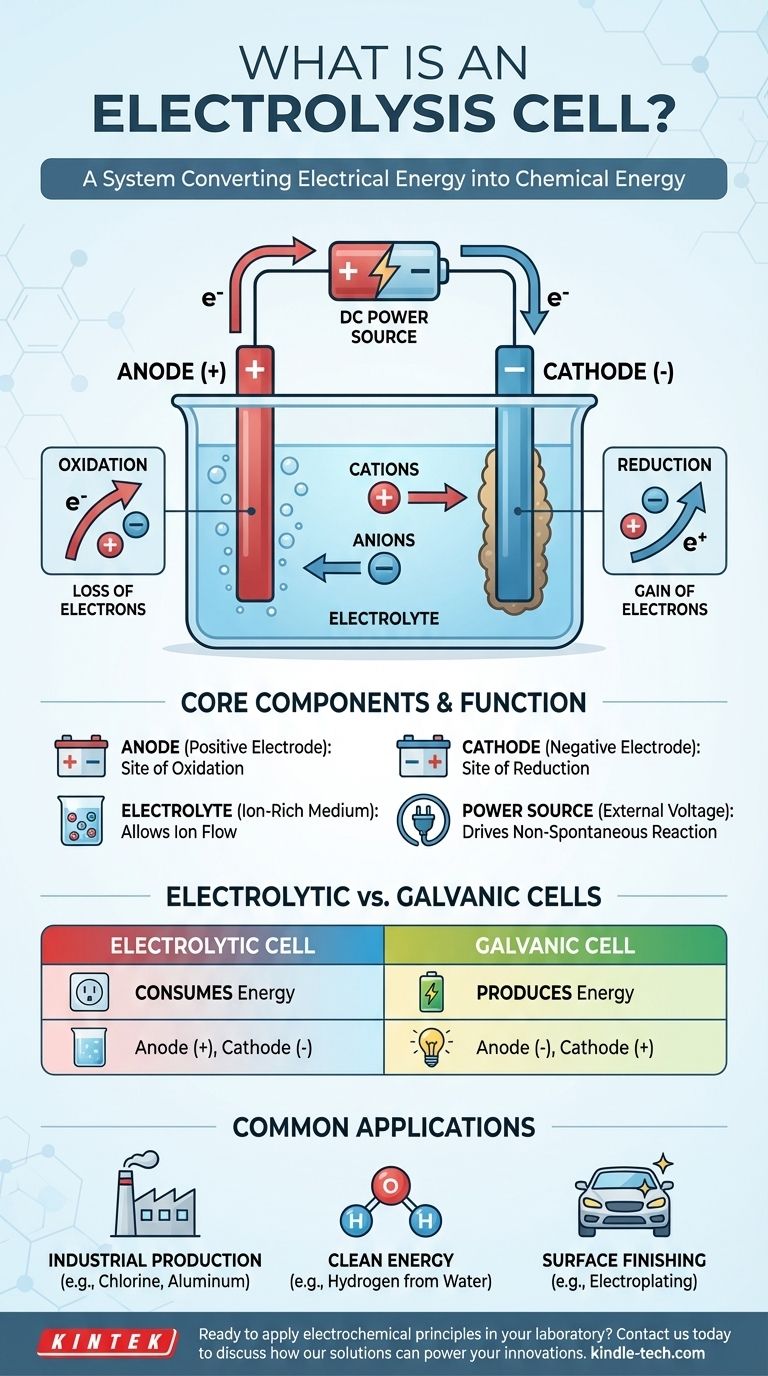
По сути, электролитическая ячейка — это устройство, которое использует электрическую энергию для проведения химической реакции, которая в противном случае не произошла бы сама по себе. Она эффективно обращает процесс, происходящий в батарее, потребляя энергию для разложения соединений или синтеза новых. Это достигается путем пропускания постоянного электрического тока через вещество, называемое электролитом, что вызывает химические изменения на двух электродах.
Электролитическую ячейку лучше всего понимать как систему для преобразования электрической энергии в химическую энергию. Она функционирует путем приложения внешнего напряжения для преодоления естественного состояния химической системы, заставляя ионы реагировать и создавать новые вещества.

Как работает электролитическая ячейка
Чтобы понять концепцию, важно разобраться в трех основных компонентах и том, как они взаимодействуют при подаче электричества. Этот процесс представляет собой контролируемый и направленный поток заряда, который приводит к химическим превращениям.
Три основных компонента
Электролитическая ячейка состоит из трех основных частей:
- Анод: Электрод, подключенный к положительной клемме источника питания.
- Катод: Электрод, подключенный к отрицательной клемме источника питания.
- Электролит: Вещество, содержащее свободно движущиеся ионы, такое как расплавленная соль или ионное соединение, растворенное в растворителе, например, в воде.
Роль внешнего напряжения
В отличие от батареи (гальванического элемента), которая спонтанно вырабатывает напряжение, электролитическая ячейка требует внешнего источника питания. Это приложенное напряжение создает мощное электрическое поле и определяет полярность электродов, делая анод положительным, а катод отрицательным.
Поток ионов и электронов
Приложенное напряжение заставляет ионы внутри электролита мигрировать. Положительно заряженные ионы (катионы) притягиваются к отрицательному катоду, в то время как отрицательно заряженные ионы (анионы) притягиваются к положительному аноду. Эта миграция создает условия для химических реакций.
Окисление и восстановление: Основы химии
Фактические химические изменения происходят на поверхности электродов. Эти реакции известны как "редокс-реакции", сокращение от восстановления и окисления.
Анод: Место окисления
Анод определяется как место окисления. Здесь анионы, мигрировавшие к положительному электроду, отдают свои избыточные электроны. Эта потеря электронов является определением окисления.
Катод: Место восстановления
Катод определяется как место восстановления. Катионы, притянутые к этому отрицательному электроду, принимают электроны из цепи. Это приобретение электронов является определением восстановления, часто приводящим к осаждению нейтрального элемента (например, металла) на катоде.
Понимание ключевого различия: Электролитические и гальванические элементы
Часто возникает путаница в различиях между электролитической ячейкой и гальванической ячейкой (например, обычной батареей). Понимание их противоположных функций имеет решающее значение.
Потребление энергии против производства энергии
Самое важное различие — это поток энергии. Электролитическая ячейка потребляет энергию для проведения несамопроизвольной реакции. Гальваническая ячейка высвобождает энергию из самопроизвольной реакции.
Полярность электродов
Это различие в функциях приводит к противоположному обозначению знаков для электродов.
- В электролитической ячейке анод положительный, а катод отрицательный.
- В гальванической ячейке анод отрицательный, а катод положительный.
Помните, что в обоих типах ячеек окисление всегда происходит на аноде, а восстановление всегда происходит на катоде. Меняется только полярность.
Общие применения электролиза
Способность вызывать химические изменения с помощью электричества делает электролитические ячейки невероятно полезными во многих отраслях промышленности.
Промышленное производство
Электролиз является краеугольным камнем хлорно-щелочной промышленности, которая производит газообразный хлор и гидроксид натрия. Он также необходим для производства чистых металлов, таких как алюминий и медь, из их руд.
Чистая энергия
Одним из наиболее перспективных применений является электролиз воды. Пропуская ток через воду, ее можно разделить на составляющие элементы: водород и кислород. Полученный водород может быть использован в качестве чистого топлива.
Отделка поверхности
Гальванопокрытие — это распространенный процесс, при котором электролитическая ячейка используется для осаждения тонкого слоя одного металла (например, золота или хрома) на поверхность другого объекта, который действует как катод.
Выбор правильного решения для вашей цели
Понимание принципа электролиза позволяет применять его для достижения конкретных целей.
- Если ваша основная цель — производство материалов (например, водорода): Признайте, что ячейка является инструментом для разложения стабильных, низкоэнергетических соединений (таких как вода) на высокоэнергетические, ценные продукты (такие как газообразный H₂).
- Если ваша основная цель — нанесение покрытий (гальванопокрытие): Поймите, что ваш целевой объект должен быть катодом, так как именно здесь положительные ионы металла будут восстанавливаться и осаждаться в виде твердого слоя.
- Если ваша основная цель — фундаментальная электрохимия: Самый важный вывод заключается в том, что электролитическая ячейка использует внешнюю энергию для обращения естественного химического процесса, что делает ее мощным двигателем для синтеза.
Освоив эти принципы, вы сможете использовать электролиз как мощный и точный инструмент для химических превращений.
Сводная таблица:
| Компонент | Функция | Ключевая характеристика |
|---|---|---|
| Анод | Место окисления (потеря электронов) | Подключен к положительной клемме источника питания |
| Катод | Место восстановления (получение электронов) | Подключен к отрицательной клемме источника питания |
| Электролит | Обеспечивает среду для потока ионов | Расплавленная соль или ионный раствор, содержащий свободно движущиеся ионы |
| Источник питания | Запускает несамопроизвольную реакцию | Обеспечивает внешнее напряжение, необходимое для электролиза |
Готовы применить электрохимические принципы в своей лаборатории?
Независимо от того, включает ли ваш проект синтез материалов, гальванопокрытие или разработку решений для чистой энергии, наличие правильного оборудования имеет основополагающее значение. KINTEK специализируется на предоставлении высококачественного лабораторного оборудования и расходных материалов для поддержки ваших электрохимических исследований и разработок.
Свяжитесь с нами сегодня, чтобы обсудить, как наши решения могут способствовать вашим инновациям и обеспечить точность и надежность, необходимые вашей лаборатории.
Визуальное руководство
Связанные товары
- Электрохимическая ячейка с пятью портами
- Электролитическая ячейка H-типа Тройная электрохимическая ячейка
- Двухслойная оптическая электролитическая электрохимическая ячейка H-типа с водяной баней
- Кварцевая электрохимическая ячейка для электрохимических экспериментов
- Электрохимическая ячейка для оценки покрытий
Люди также спрашивают
- Каковы стандартные компоненты пятипортовой электролитической ячейки с водяной баней? Освойте прецизионный прибор для электрохимического анализа
- Как следует чистить пятипортовый электрохимический стакан с водяной рубашкой для технического обслуживания? Пошаговое руководство для получения надежных результатов
- Каковы правильные процедуры хранения многофункциональной электролитической ячейки? Защитите свои инвестиции и обеспечьте точность данных
- Из какого материала изготовлена пятипортовая электролитическая ячейка с водяной баней? Объяснение по высокоборосиликатному стеклу и ПТФЭ
- Как следует эксплуатировать пятипортовую электролитическую ячейку с водяной баней во время эксперимента? Освойте точное управление для получения надежных результатов



















