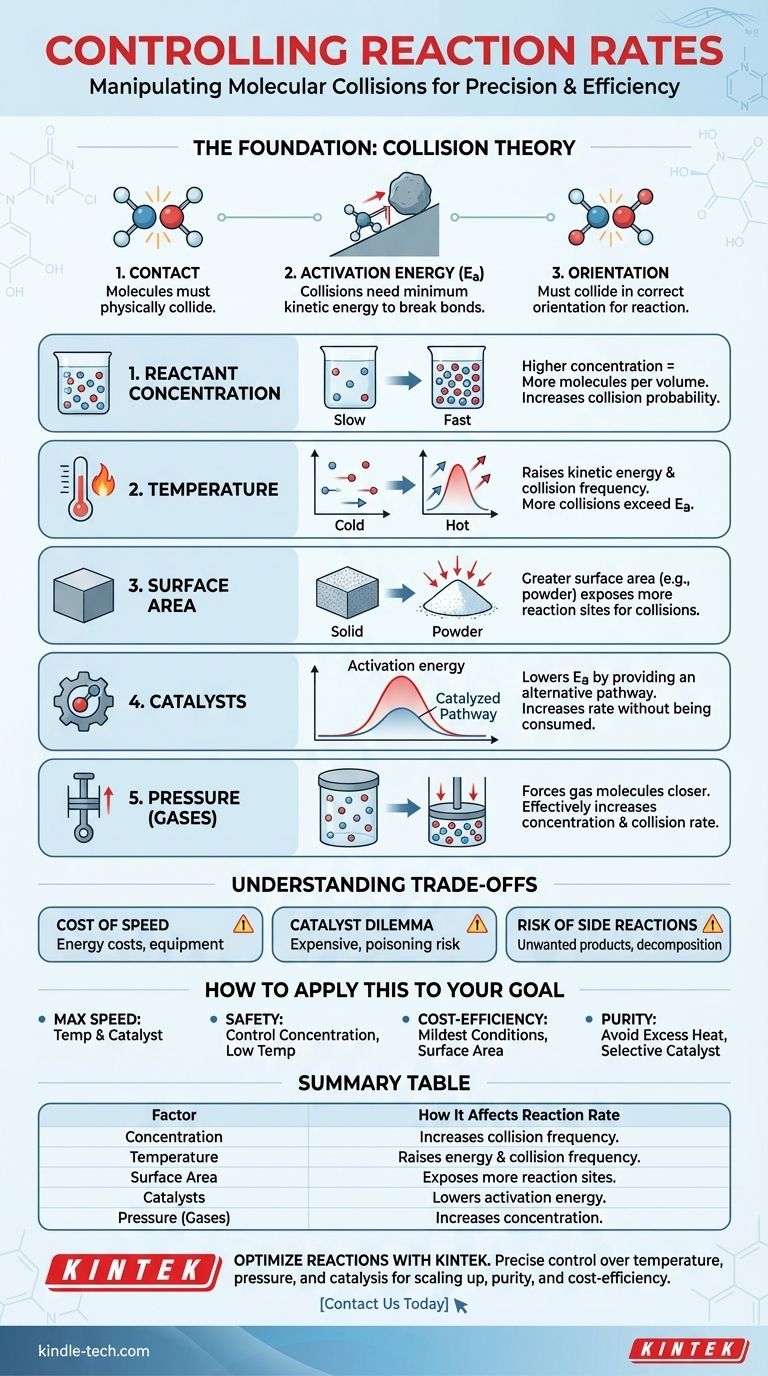
По сути, скорость химической реакции контролируется пятью основными факторами: концентрацией реагентов, температурой, физическим состоянием и площадью поверхности реагентов, наличием катализатора и, для газов, давлением. Каждый из этих факторов влияет на частоту и энергию молекулярных столкновений, что является фундаментальным движущим фактором всех химических изменений.
Скорость любой химической реакции определяется тем, как часто молекулы реагентов сталкиваются с правильной ориентацией и с достаточной энергией, чтобы преодолеть барьер энергии активации реакции. Все, что контролирует скорость реакции, — это просто рычаг для манипулирования частотой и эффективностью этих столкновений.

Основа: Теория столкновений
Чтобы контролировать реакцию, вы должны сначала понять, что реакции не являются мгновенными событиями. Они являются результатом физических взаимодействий между молекулами. Это объясняется теорией столкновений.
Необходимость контакта
Чтобы реакция произошла, молекулы реагентов должны физически сталкиваться друг с другом. Если они находятся в разных емкостях, реакция не произойдет. Скорость реакции напрямую связана со скоростью этих столкновений.
Требование к энергии (Энергия активации)
Одного столкновения недостаточно. Сталкивающиеся молекулы должны обладать определенным минимальным количеством кинетической энергии, известной как энергия активации (Ea). Эта энергия необходима для разрыва существующих химических связей, чтобы могли образоваться новые.
Представьте энергию активации как холм, через который нужно перекатить валун. Легкого толчка (столкновения с низкой энергией) будет недостаточно. Вам нужно приложить достаточно сильный толчок (достаточную энергию), чтобы поднять его на вершину холма, после чего он сможет скатиться с другой стороны и высвободить энергию.
Фактор ориентации
Наконец, молекулы должны сталкиваться в определенной ориентации, которая позволяет разорвать нужные связи и образовать новые. Случайное столкновение под неправильным углом, даже если оно достаточно энергично, не приведет к реакции.
Пять рычагов для контроля скорости реакции
Понимание теории столкновений дает вам пять различных рычагов, которые можно использовать для ускорения или замедления реакции. Каждый из них работает путем влияния на частоту столкновений, энергию столкновений или сам барьер энергии активации.
1. Концентрация реагентов
Увеличение концентрации реагентов означает, что в заданном объеме упаковано больше молекул. Это напрямую увеличивает вероятность их столкновения, тем самым увеличивая скорость реакции.
2. Температура
Повышение температуры имеет мощный двойной эффект. Во-первых, оно увеличивает кинетическую энергию молекул, заставляя их двигаться быстрее и сталкиваться чаще. Во-вторых, и это более важно, оно увеличивает энергию этих столкновений, что означает, что больший процент из них будет обладать достаточной энергией для преодоления барьера энергии активации.
3. Физическое состояние и площадь поверхности
Это наиболее актуально для реакций, включающих разные фазы, например, твердое вещество, реагирующее с жидкостью (гетерогенные реакции). Твердый блок имеет ограниченную площадь поверхности, на которой могут происходить столкновения. Измельчение этого же блока в мелкий порошок резко увеличивает его площадь поверхности, обнажая больше молекул и создавая гораздо больше мест для протекания реакций.
4. Катализаторы
Катализатор увеличивает скорость реакции, не расходуясь в процессе. Он делает это, предоставляя альтернативный путь реакции с более низкой энергией активации.
Возвращаясь к нашей аналогии, катализатор — это как прорыть туннель через холм. Вам больше не нужно толкать валун до самой вершины; вы можете доставить его на другую сторону с гораздо меньшими усилиями. Это позволяет большему числу молекул успешно реагировать, даже при более низких температурах.
5. Давление (для газообразных реакций)
Для реакций с участием газов увеличение давления заставляет молекулы газа сближаться. Это по сути то же самое, что и увеличение их концентрации, что приводит к более частым столкновениям и более быстрой скорости реакции.
Понимание компромиссов
Манипулирование скоростями реакции не обходится без последствий. Эффективный технический консультант должен учитывать практические и экономические последствия каждого выбора.
Цена скорости
Повышение температуры и давления требует энергии, что стоит денег. Это также может потребовать специализированных реакторов высокого давления, которые дороги в строительстве и обслуживании, что влечет за собой соображения безопасности.
Дилемма катализатора
Катализаторы могут быть очень эффективными, но часто дорогими (например, при использовании драгоценных металлов, таких как платина или палладий). Они также могут быть очень специфичными для одной реакции и могут быть деактивированы примесями, что называется «отравлением катализатора».
Риск нежелательных побочных реакций
Слишком сильное форсирование реакции, особенно при чрезмерном нагревании, может привести к нежелательным результатам. Реагенты или продукты могут начать разлагаться, или повышенная энергия может способствовать нежелательным побочным реакциям, снижая чистоту и выход желаемого продукта.
Как применить это к вашей цели
Ваша стратегия контроля реакции полностью зависит от того, чего вы пытаетесь достичь.
- Если ваш основной фокус — максимальная скорость: Наиболее мощными рычагами являются повышение температуры и использование эффективного катализатора, поскольку оба резко увеличивают количество успешных, энергичных столкновений.
- Если ваш основной фокус — безопасность и контроль: Лучшими подходами являются тщательное управление концентрацией реагентов (например, медленное добавление одного реагента к другому) и использование самой низкой эффективной температуры.
- Если ваш основной фокус — экономическая эффективность: Оптимизируйте условия до максимально мягких. Это может включать поиск доступного катализатора или увеличение площади поверхности, чтобы избежать высоких энергетических затрат, связанных с экстремальным нагревом и давлением.
- Если ваш основной фокус — чистота продукта: Избегайте чрезмерно высоких температур, которые могут вызвать разложение или побочные реакции, и убедитесь, что ваш катализатор высокоселективен по отношению к желаемой реакции.
В конечном счете, контроль химической реакции — это искусство точного управления условиями, которые определяют молекулярные столкновения.
Сводная таблица:
| Фактор | Как влияет на скорость реакции |
|---|---|
| Концентрация | Более высокая концентрация увеличивает частоту столкновений между молекулами реагентов. |
| Температура | Повышает энергию молекул и частоту столкновений; больше столкновений превышает энергию активации. |
| Площадь поверхности | Большая площадь поверхности (например, порошкообразное твердое вещество) обнажает больше мест для столкновений. |
| Катализаторы | Снижает энергию активации, предоставляя альтернативный путь реакции. |
| Давление (Газы) | Увеличивает концентрацию молекул газа, что приводит к более частым столкновениям. |
Оптимизируйте свои химические реакции с помощью точного оборудования от KINTEK. Независимо от того, увеличиваете ли вы производство, обеспечиваете чистоту продукции или максимизируете экономическую эффективность, наше лабораторное оборудование и расходные материалы разработаны для обеспечения точного контроля над условиями реакции. Позвольте нашим экспертам помочь вам выбрать правильные инструменты для управления температурой, давлением и катализом для ваших конкретных нужд. Свяжитесь с нами сегодня, чтобы обсудить, как мы можем поддержать успех вашей лаборатории!
Визуальное руководство
Связанные товары
- Миниавтоклав высокого давления из нержавеющей стали для лабораторного использования
- Реактор высокого давления из нержавеющей стали, лабораторный реактор высокого давления
- Настраиваемые реакторы высокого давления для передовых научных и промышленных применений
- Автоматический гидравлический пресс с подогревом и нагревательными плитами для лабораторного горячего прессования 25Т 30Т 50Т
Люди также спрашивают
- Какие существуют типы пиролизного оборудования? Выберите подходящий реактор для вашего процесса
- Что такое реактор постоянного давления? Контролируйте среду реакции для получения точных результатов
- Какова технологическая ценность двухстадийного тандемного реактора для биомассы ивы? Увеличьте выход метана
- Какова функция реактора с высокоскоростной лопастной мешалкой? Точное осаждение гидроксида магния
- Почему реакторы для получения наночастиц оксида железа должны оснащаться точным перемешиванием? Обеспечение однородности
- Каковы конструктивные особенности биореакторов? Создайте идеальную среду для роста клеток
- Почему крайне важно ограничивать ПВХ в системах переработки пластика? Защитите свой реактор из нержавеющей стали от коррозии
- Каково рабочее давление реактора? Ваш процесс определяет конструкцию



