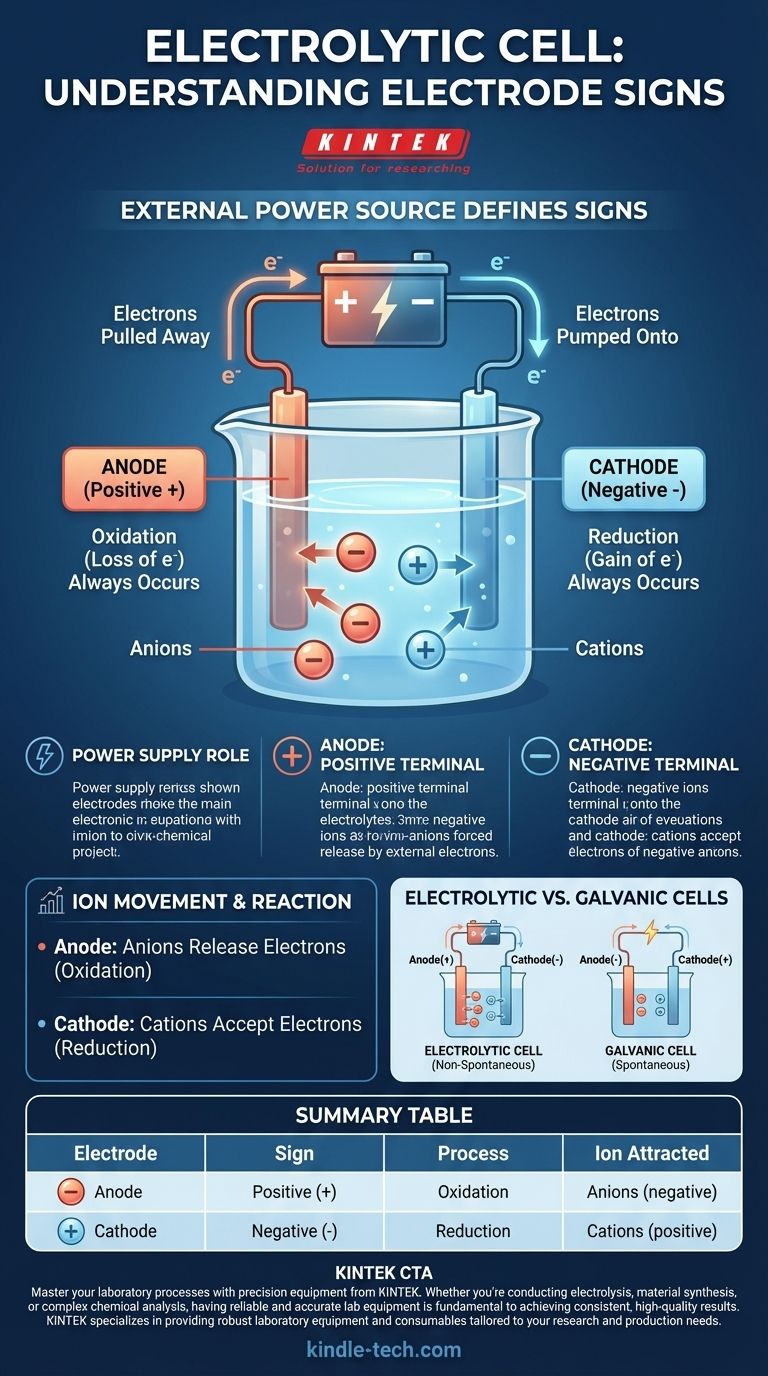
В электролитической ячейке обозначение знаков определяется внешним источником питания. Аноду присваивается положительный (+) знак, а катоду присваивается отрицательный (-) знак. Это связано с тем, что внешнее напряжение подается для осуществления химической реакции, которая не протекала бы самопроизвольно.
Ключ к пониманию электролитической ячейки заключается в признании того, что это не автономная система. Знаки ее электродов полностью диктуются внешним источником питания, к которому она подключена, что вынуждает происходить несамопроизвольное химическое изменение.

Почему внешний источник питания определяет знаки
Электролитическая ячейка использует электрическую энергию для создания химической энергии. Этот процесс, известный как электролиз, требует внешней силы — батареи или источника постоянного тока — для инициирования и поддержания реакции.
Роль источника питания
Источник питания действует как «электронный насос». Он оттягивает электроны от одного электрода и проталкивает их к другому, создавая дисбаланс заряда, который заставляет ионы в растворе электролита реагировать.
Анод подключен к положительной клемме
Положительная клемма внешнего источника питания подключена к аноду. Эта клемма активно оттягивает электроны от анода, оставляя его с чистым положительным зарядом.
Катод подключен к отрицательной клемме
И наоборот, отрицательная клемма источника питания подключена к катоду. Эта клемма активно накачивает электроны на катод, давая ему избыток электронов и чистый отрицательный заряд.
Как движение ионов создает реакцию
Принудительные заряды на электродах притягивают ионы, растворенные в электролите, заставляя их двигаться и реагировать. Фундаментальные определения окисления и восстановления остаются постоянными.
Анод: Место окисления (всегда)
Независимо от типа ячейки, окисление (потеря электронов) всегда происходит на аноде. В электролитической ячейке отрицательно заряженные ионы (анионы) притягиваются к положительному аноду, где они отдают свои избыточные электроны и окисляются.
Катод: Место восстановления (всегда)
Аналогично, восстановление (приобретение электронов) всегда происходит на катоде. Положительно заряженные ионы (катионы) в растворе притягиваются к отрицательному катоду, где они принимают избыточные электроны и восстанавливаются.
Критическое различие: электролитические и гальванические ячейки
Основной источник путаницы возникает при сравнении электролитических ячеек с гальваническими (или вольтаическими) ячейками, такими как стандартная батарея. Их обозначения знаков противоположны по очень специфической причине.
Самопроизвольные и несамопроизвольные реакции
Гальваническая ячейка работает на самопроизвольной химической реакции, которая производит электрическую энергию. Здесь анод является естественным источником электронов, что делает его отрицательным, а катод — местом их потребления, что делает его положительным.
Электролитическая ячейка запускает несамопроизвольную реакцию, которая потребляет электрическую энергию. Внешний источник питания меняет естественную полярность, чтобы заставить реакцию протекать.
Универсальная константа
Несмотря на разницу в знаках, основные процессы одинаковы в обоих типах ячеек:
- Анод всегда является местом окисления.
- Катод всегда является местом восстановления.
Как запомнить знаки
Используйте эти принципы, чтобы четко понимать обозначения в зависимости от вашей цели.
- Если ваша основная цель — идентификация клемм: Помните, что в электролитической ячейке знаки соответствуют внешнему источнику питания: анод положителен, а катод отрицателен.
- Если ваша основная цель — отслеживание ионов: Следуйте простому правилу противоположных зарядов: отрицательные анионы движутся к положительному аноду, а положительные катионы движутся к отрицательному катоду.
- Если ваша основная цель — различение типов ячеек: Ассоциируйте «электролитический» с внешним источником питания, который принудительно создает положительный заряд на аноде и отрицательный заряд на катоде для запуска реакции.
В конечном итоге, знаки электролитической ячейки являются прямым следствием того, что внешний источник питания отменяет естественный ход химической реакции.
Сводная таблица:
| Электрод | Знак | Процесс | Притягиваемый ион |
|---|---|---|---|
| Анод | Положительный (+) | Окисление | Анионы (отрицательные) |
| Катод | Отрицательный (-) | Восстановление | Катионы (положительные) |
Освойте свои лабораторные процессы с прецизионным оборудованием от KINTEK.
Независимо от того, проводите ли вы электролиз, синтез материалов или сложный химический анализ, наличие надежного и точного лабораторного оборудования является основополагающим для достижения стабильных, высококачественных результатов. KINTEK специализируется на предоставлении надежного лабораторного оборудования и расходных материалов, адаптированных к вашим исследовательским и производственным потребностям.
Свяжитесь с нашими экспертами сегодня, чтобы обсудить, как наши решения могут способствовать вашим инновациям и повысить эффективность ваших лабораторных рабочих процессов.
Визуальное руководство
Связанные товары
- Электрохимическая ячейка с пятью портами
- Двухслойная пятипортовая электрохимическая ячейка с водяной баней
- Электрохимическая ячейка с двухслойной водяной баней
- Кварцевая электрохимическая ячейка для электрохимических экспериментов
- Оптическая электрохимическая ячейка с водяной баней
Люди также спрашивают
- Как следует обращаться с тонкослойной спектроэлектрохимической ячейкой для обеспечения ее долговечности? Советы экспертов по техническому обслуживанию
- Каковы преимущества использования кварцевого стекла в качестве материала для ячейки реактора электрокаталитического окисления?
- Как избежать загрязнения при проведении экспериментов в электролитической ячейке? Обеспечение чистоты и точности результатов
- Каково значение герметичного электролизера для производства синтез-газа? Обеспечение высокой чистоты и точности данных
- Каковы основные преимущества трехэлектродной электролитической ячейки для исследований кинетики окисления этанола?
- Какова структура сверхгерметичной электролитической ячейки? Руководство по ее герметичной конструкции
- В чем разница между электролитом и электродом в ячейке? Освойте основы электрохимических систем
- Каковы преимущества использования системы микроэлектролитических ячеек? Оптимизация характеристики сплавов Mg-Ag



















