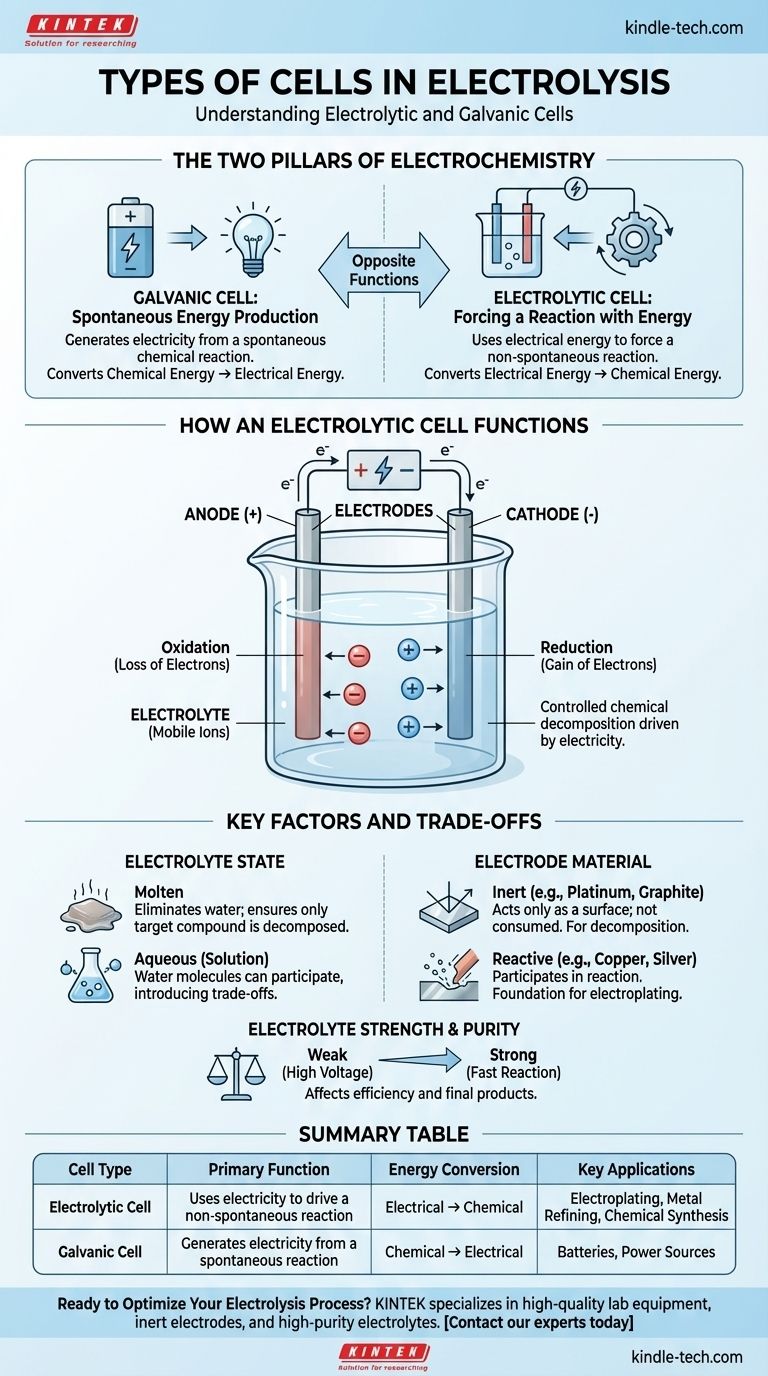
По своей сути электролиз происходит внутри особого типа электрохимической ячейки, известной как электролитическая ячейка. Эта ячейка является одним из двух основных типов электрохимических ячеек, другой — гальваническая ячейка. Электролитическая ячейка использует электрическую энергию для принудительного осуществления несамопроизвольной химической реакции, в то время как гальваническая ячейка делает обратное, генерируя электричество за счет самопроизвольной химической реакции.
Ключевое различие заключается в цели. Гальваническая ячейка (например, батарея) производит электричество за счет химической реакции. Электролитическая ячейка использует электричество для проведения химической реакции, которая не произошла бы сама по себе.

Два столпа электрохимии
Чтобы понять ячейку, используемую для электролиза, вы должны сначала понять ее аналог. Оба типа ячеек имеют фундаментальное значение для электрохимии, но они служат противоположным целям.
Гальваническая ячейка: самопроизвольная выработка энергии
Гальваническая ячейка — это то, что мы обычно называем батареей. Она использует самопроизвольную химическую реакцию, которая естественным образом хочет произойти.
По мере протекания этой реакции она выделяет энергию в виде электрического тока. Она напрямую преобразует запасенную химическую энергию в электрическую.
Электролитическая ячейка: принуждение к реакции с помощью энергии
Электролитическая ячейка — это двигатель электролиза. Она предназначена для осуществления несамопроизвольной химической реакции путем подачи внешней энергии.
Вы подаете электрический ток из внешнего источника (например, блока питания) на ячейку. Это заставляет вещество разлагаться, эффективно преобразуя электрическую энергию обратно в химическую путем образования новых веществ.
Как работает электролитическая ячейка
Процесс электролиза — это контролируемое химическое разложение, вызванное электричеством. Для этого требуется согласованная работа нескольких ключевых компонентов.
Основные компоненты
Электролитическая ячейка состоит из двух электродов (положительного анода и отрицательного катода), погруженных в электролит. К этим электродам подключается внешний источник питания, образуя цепь.
Роль электролита
Электролит — это вещество, которое будет разлагаться. Обычно это ионное соединение, находящееся либо в расплавленном состоянии, либо растворенное в растворе (водном).
Это вещество должно содержать подвижные ионы, которые свободны перемещаться и переносить заряд. Электролиты, как правило, представляют собой растворы кислот, оснований или солей.
Функция электродов
Электроды — это проводники, через которые электричество входит в электролит и выходит из него.
- Анод: Положительный электрод. Он притягивает отрицательные ионы (анионы), где происходит окисление (потеря электронов).
- Катод: Отрицательный электрод. Он притягивает положительные ионы (катионы), где происходит восстановление (приобретение электронов).
Внешний источник питания поддерживает это разделение зарядов и управляет всем процессом.
Понимание ключевых факторов и компромиссов
Результат электролиза не является автоматическим. Конкретные продукты, которые вы получаете, полностью зависят от выбранных вами материалов и условий.
Состояние электролита: расплавленный или водный
Состояние электролита является критически важным решением. Если вы используете водный раствор (растворенный в воде), сами молекулы воды могут участвовать в реакции.
Это создает компромисс, поскольку электричество может расщеплять воду вместо растворенного соединения, в зависимости от того, какую реакцию легче провести. Использование расплавленного электролита исключает воду из уравнения, гарантируя разложение только целевого соединения.
Материал электрода: инертный или реактивный
Электроды могут быть пассивными участниками или активными игроками в реакции.
- Инертные электроды (например, платина, графит): Они служат только поверхностью для протекания реакции. Они не расходуются и используются, когда вы хотите разложить сам электролит, например, разложить воду на водород и кислород.
- Реактивные электроды (например, медь, серебро): Они могут растворяться или участвовать в химической реакции. Это принцип, лежащий в основе гальванотехники (электроосаждения), когда анод растворяется, а ионы этого металла осаждаются на объекте на катоде.
Концентрация и чистота электролита
На эффективность электролиза также влияет электролит. Сильные электролиты, которые полностью диссоциируют на ионы, хорошо проводят электричество и обеспечивают более быструю реакцию.
Слабые электролиты требуют больше энергии (более высокого напряжения) для инициирования и поддержания реакции. Присутствие других окислителей или восстановителей в электролите также может изменить конечные продукты.
Применение этого к вашей цели
Понимание функции электролитической ячейки позволяет вам контролировать химические реакции для конкретных промышленных и научных целей.
- Если ваша основная цель — получение чистого вещества: Выберите инертный электрод и электролит высокой чистоты (расплавленный или водный), чтобы гарантировать разложение целевого соединения, например, при получении алюминия из бокситовой руды.
- Если ваша основная цель — нанесение покрытия или очистка металла: Используйте реактивный анод из покрывающего материала и электролит, содержащий ионы этого же металла. Это основа гальванотехники и электролитического рафинирования.
- Если ваша основная цель — выработка электричества: Вам нужна гальваническая ячейка, а не электролитическая, поскольку ее функция заключается в высвобождении энергии за счет самопроизвольной реакции.
В конечном счете, электролиз предоставляет мощный метод использования электрической энергии для точного контроля и проведения химических изменений.
Сводная таблица:
| Тип ячейки | Основная функция | Преобразование энергии | Ключевые области применения |
|---|---|---|---|
| Электролитическая ячейка | Использует электричество для проведения несамопроизвольной реакции | Электрическая → Химическая | Гальванотехника, Рафинирование металлов, Химический синтез |
| Гальваническая ячейка | Генерирует электричество за счет самопроизвольной реакции | Химическая → Электрическая | Батареи, Источники питания |
Готовы оптимизировать свой процесс электролиза?
Понимание правильного типа ячейки и компонентов имеет решающее значение для эффективной гальванотехники, рафинирования металлов или химического синтеза. KINTEK специализируется на предоставлении высококачественного лабораторного оборудования и расходных материалов, включая инертные электроды и высокочистые электролиты, чтобы гарантировать точность и эффективность ваших электролитических процессов.
Свяжитесь с нашими экспертами сегодня, чтобы обсудить ваше конкретное применение и узнать, как наши решения могут повысить возможности и результаты вашей лаборатории.
Визуальное руководство
Связанные товары
- Электрохимическая ячейка с пятью портами
- Кварцевая электрохимическая ячейка для электрохимических экспериментов
- Двухслойная оптическая электролитическая электрохимическая ячейка H-типа с водяной баней
- Электролитическая ячейка H-типа Тройная электрохимическая ячейка
- Электрохимическая ячейка из ПТФЭ, коррозионностойкая, герметичная и негерметичная
Люди также спрашивают
- Каков надлежащий способ обращения с пятипортовой электролитической ячейкой с водяной баней? Обеспечение точных и безопасных электрохимических экспериментов
- Как предотвратить утечки при использовании пятипортовой электролитической ячейки с водяной баней? Обеспечьте надежную и безопасную электрохимическую установку
- Как следует обслуживать корпус электролитической ячейки для обеспечения долговечности? Продлите срок службы вашего оборудования
- Какую общую меру предосторожности следует соблюдать при работе с электролитической ячейкой? Обеспечьте безопасность и точность лабораторных результатов
- Как следует чистить пятипортовый электрохимический стакан с водяной рубашкой для технического обслуживания? Пошаговое руководство для получения надежных результатов



















