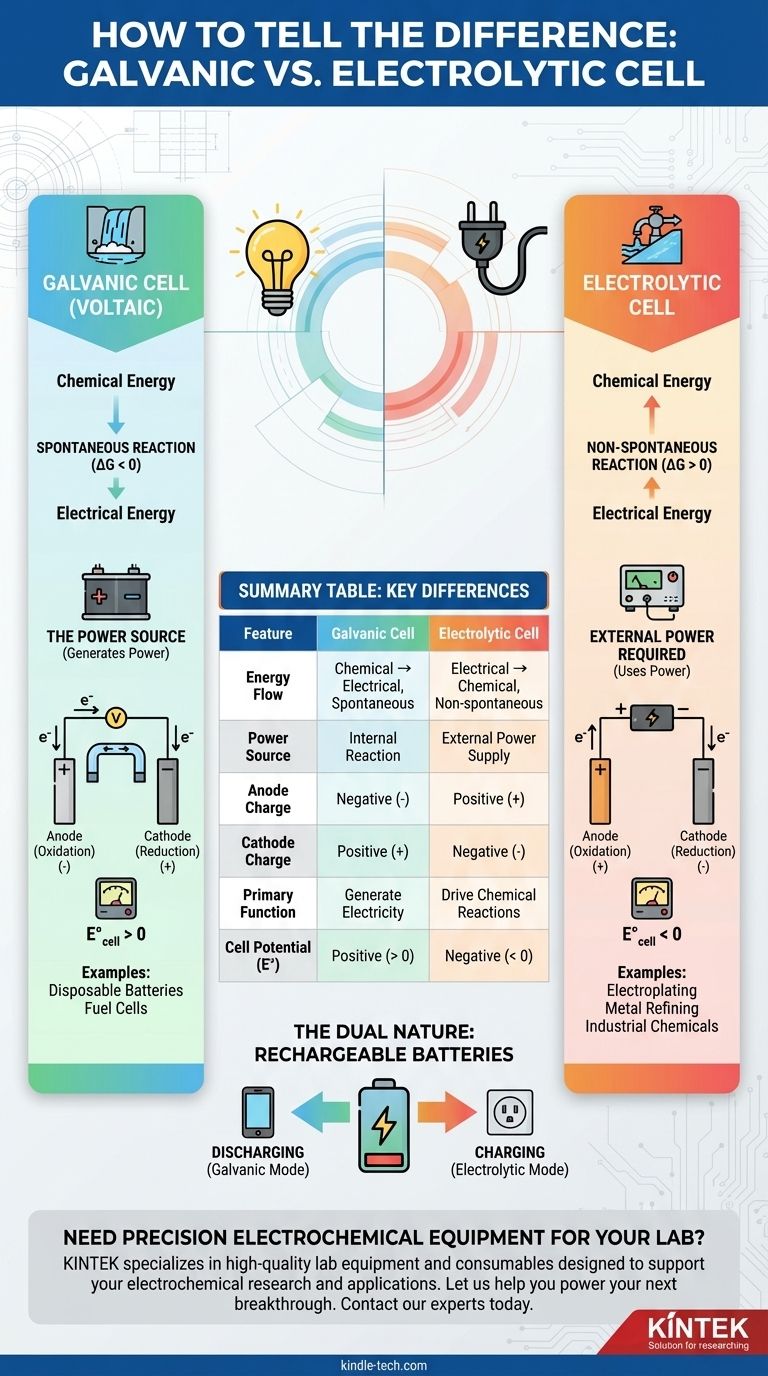
Фундаментальное различие между гальваническим и электролитическим элементом заключается в потоке энергии. Гальванический элемент, также известный как вольтов элемент, использует самопроизвольную химическую реакцию для выработки электрической энергии. В отличие от него, электролитический элемент использует внешнюю электрическую энергию, чтобы заставить произойти несамопроизвольную химическую реакцию.
Представьте это так: Гальванический элемент подобен водопаду, вырабатывающему энергию, когда вода естественным образом течет вниз. Электролитический элемент подобен насосу, использующему внешнюю энергию для перекачивания воды вверх против силы тяжести.

Основной принцип: самопроизвольность и преобразование энергии
Поведение любого электрохимического элемента определяется тем, протекает ли его внутренняя реакция самостоятельно или требует внешнего вмешательства.
Гальванические элементы: высвобождение химической энергии
Гальванический элемент определяется самопроизвольной окислительно-восстановительной реакцией. Это означает, что реакция стремится произойти сама по себе, высвобождая при этом энергию.
Этот процесс преобразует запасенную химическую энергию непосредственно в электрическую энергию. Сам элемент является источником питания.
Термодинамически это соответствует отрицательной энергии Гиббса (ΔG < 0) и положительному потенциалу элемента (E°_cell > 0).
Электролитические элементы: ввод электрической энергии
Электролитический элемент включает несамопроизвольную реакцию. Без внешнего воздействия эта реакция не произошла бы.
Для протекания реакции требуется внешний источник питания, такой как батарея или источник постоянного тока. Этот процесс преобразует электрическую энергию в химическую энергию.
Это соответствует положительной энергии Гиббса (ΔG > 0) и отрицательному потенциалу элемента (E°_cell < 0). Внешнее напряжение должно быть больше этого отрицательного потенциала, чтобы заставить реакцию произойти.
Как определить каждый элемент: ключевые индикаторы
Помимо направления потока энергии, вы можете различать два типа элементов, наблюдая за полярностью электродов и общей схемой.
Источник питания
Это самый простой индикатор. Если электрохимический элемент является батареей, питающей устройство, это гальванический элемент.
Если элемент подключен к внешней батарее или источнику питания, это электролитический элемент. Внешний источник обеспечивает энергию для протекания процесса.
Полярность электродов (частый источник путаницы)
Определения анода и катода постоянны для обоих типов элементов:
- Анод: Электрод, где происходит окисление.
- Катод: Электрод, где происходит восстановление.
Однако их положительный/отрицательный заряд (полярность) меняется:
В гальваническом элементе самопроизвольная реакция на аноде высвобождает электроны, делая его отрицательным (-) полюсом. Катод, который потребляет электроны, является положительным (+) полюсом.
В электролитическом элементе внешний источник питания определяет полярность. Он оттягивает электроны от анода, делая его положительным (+) полюсом, и толкает электроны к катоду, делая его отрицательным (-) полюсом.
Распространенные применения и подводные камни
Назначение элемента является его наиболее практичным отличительным признаком. Один вырабатывает энергию, а другой использует энергию для создания вещества или изменения.
Назначение гальванического элемента
Единственная функция гальванического элемента — служить источником электрической энергии.
Типичные примеры включают одноразовые батарейки (AA, AAA), топливные элементы и основную функцию автомобильного аккумулятора при запуске двигателя.
Назначение электролитического элемента
Цель электролитического элемента — вызвать полезное химическое превращение, которое иначе не произошло бы.
Типичные применения включают гальванопокрытие тонкого слоя металла на поверхности, рафинирование металлов, таких как медь и алюминий, и производство промышленных химикатов, таких как газообразный хлор.
Двойственная природа перезаряжаемых батарей
Перезаряжаемая батарея является идеальным примером обоих типов элементов в одном устройстве.
- При разрядке (питание телефона): Она действует как гальванический элемент, с самопроизвольной реакцией, генерирующей электричество.
- При зарядке (подключена к сети): Она действует как электролитический элемент, с внешней энергией, заставляющей несамопроизвольную обратную реакцию запасать энергию.
Правильное различие для вашей цели
Чтобы быстро определить, с каким элементом вы имеете дело, сосредоточьтесь на потоке энергии и общей цели системы.
- Если ваша основная цель — выработка энергии: Вы имеете дело с гальваническим элементом, где самопроизвольная реакция высвобождает энергию.
- Если ваша основная цель — создание вещества или обращение реакции: Вы используете электролитический элемент, который требует внешнего источника питания для запуска несамопроизвольного процесса.
- Если вы анализируете знаки электродов: Помните, что в гальваническом элементе анод отрицателен, тогда как в электролитическом элементе он положителен, потому что источник энергии является либо внутренним, либо внешним.
В конечном счете, понимание того, является ли энергия продуктом или требованием, является ключом к различению этих двух фундаментальных электрохимических элементов.
Сводная таблица:
| Характеристика | Гальванический элемент | Электролитический элемент |
|---|---|---|
| Поток энергии | Химическая → Электрическая (самопроизвольная) | Электрическая → Химическая (несамопроизвольная) |
| Источник питания | Внутренняя реакция | Внешний источник питания |
| Заряд анода | Отрицательный (-) | Положительный (+) |
| Заряд катода | Положительный (+) | Отрицательный (-) |
| Основная функция | Генерация электричества | Запуск химических реакций (например, гальванопокрытие) |
| Потенциал элемента (E°) | Положительный (> 0) | Отрицательный (< 0) |
Нужно точное электрохимическое оборудование для вашей лаборатории?
Понимание нюансов гальванических и электролитических элементов имеет решающее значение для передовых лабораторных работ. Независимо от того, разрабатываете ли вы новые аккумуляторные технологии, выполняете гальванопокрытие или проводите анализ материалов, наличие правильного оборудования крайне важно.
KINTEK специализируется на высококачественном лабораторном оборудовании и расходных материалах, разработанных для поддержки ваших электрохимических исследований и применений. Мы предоставляем надежные решения, которые обеспечивают точные результаты и повышают эффективность вашей лаборатории.
Позвольте нам помочь вам совершить ваш следующий прорыв. Свяжитесь с нашими экспертами сегодня, чтобы обсудить ваши конкретные лабораторные потребности и узнать, как наши продукты могут способствовать вашему успеху.
Визуальное руководство
Связанные товары
- Электрохимическая ячейка с пятью портами
- Электрохимическая ячейка для оценки покрытий
- Электрохимическая ячейка с газодиффузионным электролизом и ячейка для реакции с протоком жидкости
- Лабораторное оборудование для аккумуляторов, тестер емкости и комплексный тестер аккумуляторов
- Гидрофильная углеродная бумага TGPH060 для лабораторных применений в области аккумуляторов
Люди также спрашивают
- Что такое H-образная ячейка? Руководство по разделенным электрохимическим ячейкам для точных экспериментов
- Почему реализация конфигурации с нулевым зазором имеет большое значение в электролизерах медно-хлорного цикла?
- Каковы преимущества использования трехэлектродной системы электролитических ячеек? Точная оценка ингибиторов коррозии
- Каковы надлежащие процедуры после использования для супергерметичной электролитической ячейки? Руководство по безопасности и долговечности
- Как трехэлектродная ячейка оценивает BDD-электроды? Мастерское картирование прецизионного электрохимического окна
- Какова функция электролитической ячейки при обогащении тритием? Повышение обнаружения для низкоуровневого анализа
- Каков типичный диапазон объема для пятипортовой электролитической ячейки с водяной баней? От 10 мл до 1000 мл
- Каковы полные шаги подготовки, которые необходимо предпринять перед использованием электрохимической ячейки с плоской пластиной для коррозионных испытаний? Обеспечьте точные и воспроизводимые результаты




