Определение и основные функции электролитической ячейки
Оглавление
Понимание роли электрической и химической энергии в электролизере.
Электрохимическая ячейка Электрохимическая ячейка — это устройство, способное либо генерировать электрическую энергию в результате химических реакций, либо облегчать химические реакции путем введения электрической энергии.
Дайте определение электрохимии. Электрохимия – это изучение химических процессов, вызывающих движение электронов. В нем рассматривается взаимодействие между электрической энергией и химическими изменениями.
Пример: Изучение электрохимических ячеек входит в область электрохимии. Речь идет о клетках, которые преобразуют химическую энергию в электрическую.
Важность электрохимии. Электрохимия изучает связи между электрическими и химическими явлениями. Электрохимические процессы используются в различных отраслях промышленности. Это наиболее важный процесс производства ряда химических веществ. Производство различных металлов основано на электрохимическом методе. Водород получают электролизом воды. Он также играет важную роль в развитии электромобилей.
Описание компонентов электролизера, включая электроды и электролит.
Электролитические ячейки состоят из трех основных компонентов.

Анод — это отрицательный или восстановительный электрод, который выделяет электроны во внешнюю цепь и окисляется во время электрохимической реакции.
Катод — это положительный или окислительный электрод, который приобретает электроны из внешней цепи и восстанавливается во время электрохимической реакции.
Электролит — это среда, обеспечивающая механизм транспорта ионов между катодом и анодом ячейки. Электролиты часто представляют собой жидкости, такие как вода или другие растворители, с растворенными солями, кислотами или щелочами, которые необходимы для ионной проводимости. Однако следует отметить, что многие батареи, включая обычные батареи (AA/AAA/D), содержат твердые электролиты, которые действуют как ионные проводники при комнатной температуре.
Соображения при выборе катода, анода и электролита
Желательные свойства материалов анода, катода и электролита указаны ниже.
Объяснение процесса переноса заряда между электродами и ионами
электролитическая ячейка, любое устройство, в котором электрическая энергия преобразуется в химическую энергию или наоборот. Такая ячейка обычно состоит из двух металлических или электронных проводников (электродов), расположенных отдельно друг от друга и контактирующих с электролитом (см.), обычно растворенным или конденсированным ионным соединением. Подключение электродов к источнику постоянного электрического тока делает один из них отрицательно заряженным, а другой — положительным. Положительные ионы в электролите мигрируют к отрицательному электроду (катоду) и там соединяются с одним или несколькими электронами, теряя часть или весь свой заряд и превращаясь в новые ионы с меньшим зарядом или нейтральные атомы или молекулы; при этом отрицательные ионы мигрируют к положительному электроду (аноду) и переносят на него один или несколько электронов, также становясь новыми ионами или нейтральными частицами. Общим эффектом этих двух процессов является перенос электронов от отрицательных ионов к положительным ионам, химическая реакция (см. окислительно-восстановительную реакцию). Примером может служить электролиз хлорида натрия (поваренной соли) с образованием металлического натрия и газообразного хлора; энергия, необходимая для протекания реакции, обеспечивается электрическим током. Другие распространенные применения электролиза включают электроосаждение для рафинирования или нанесения гальванических покрытий металлов и производство каустической соды.
Что такое электролитическая ячейка? Электролизер можно определить как электрохимическое устройство, которое использует электрическую энергию для облегчения неспонтанной окислительно-восстановительной реакции. Электролитические ячейки — это электрохимические ячейки, которые можно использовать для электролиза определенных соединений. Например, воду можно подвергнуть электролизу (с помощью электролизера) с образованием газообразного кислорода и газообразного водорода. Это делается за счет использования потока электронов (в реакционную среду) для преодоления энергетического барьера активации неспонтанной окислительно-восстановительной реакции.


Тремя основными компонентами электролизеров являются: Катод (который заряжен отрицательно для электролизеров) Анод (который заряжен положительно для электролизеров) Электролит Электролит обеспечивает среду для обмена электронами между катодом и анодом. Обычно используемые электролиты в электролизерах включают воду (содержащую растворенные ионы) и расплавленный хлорид натрия.
ЭЛЕКТРОЛИТИЧЕСКИЕ ЯЧЕЙКИ Чтобы дать определение электролитическим ячейкам, нам нужно сначала понять, что такое электролиз. Электролиз — это метод, который предполагает пропускание электрического тока через жидкость, содержащую ионы, что приводит к распаду соединений внутри. Это используется для изоляции металла от металлических элементов, отделения других химических веществ (например, воды) и гальванических металлов, а также для подзарядки батарей. Полная цепь необходима для поддержания электролитического процесса; нам нужна возможность постоянно получать электричество из клетки.
Катод и анод электролизера подключены к источнику питания. Эти два стабильных электрода и жидкий раствор электролита находятся в каждой электролитической ячейке. Раствор электролита проводит электричество, поскольку растворенные ионы могут свободно перемещаться в растворе.
Электролитическая ячейка и ее компоненты Электролитическая ячейка состоит из трех основных компонентов – батареи, электродов и электролита. Аккумулятор Аккумулятор выполняет функцию источника питания. Он обеспечивает электрическую энергию, вызывающую химические изменения, то есть разложение ионного соединения. Электроды Электроды — это электрические контакты, которые замыкают или замыкают электрическую цепь между проводами и электролитом. Примеры электродов включают угольные стержни (графит) и металлические пластины. Электрод слева (см. изображение выше), подключенный к положительной клемме батареи, является положительным электродом или анодом. Электрод справа, подключенный к отрицательной клемме батареи, является отрицательным электродом или катодом. Электролит Электролит – это вещество, которое в расплавленном или водном растворе содержит подвижные ионы, проводящие электричество. Примеры электролитов включают расплавленный хлорид натрия, раствор сульфата меди (II) и кислоты, такие как разбавленная соляная кислота. Примеры неэлектролитов включают раствор сахара, этанол, (расплавленную) серу, поскольку это жидкости или растворы, которые не содержат подвижных ионов, проводящих электричество.

Применение Электролитические ячейки часто используются для разложения химических соединений в процессе, называемом электролизом, где «электро» означает электричество, а греческое слово «лиз» означает «расщепление». Важными примерами электролиза являются разложение воды на водород и кислород, боксита на алюминий и другие химические вещества. Гальваническое покрытие (например, медью, серебром, никелем или хромом) выполняется с использованием электролитической ячейки. Электролиз – это метод, в котором используется постоянный электрический ток (DC).
В промышленных масштабах электролизеры используются при электрорафинировании и электролизе некоторых цветных металлов. Большую часть алюминия, меди, цинка и свинца высокой чистоты производят в электролитических ячейках.
Электролитическая ячейка Тремя компонентами электролитической ячейки являются электролит и два электрода.
Электролиты Электролиты — это вещества, которые образуют электропроводящий раствор при растворении в полярных растворителях, например в воде. Это связано с тем, что при растворении электролита в полярных растворителях он распадается на катионы и анионы и равномерно распределяется по раствору. Эти катионы и анионы под действием электрического потенциала в растворе движутся к электроду с избытком электронов и дефицитом электронов соответственно. Это движение катионов и анионов в направлении, противоположном друг другу, генерирует ток и образует электролитические ячейки.
Хотя соли, кислоты и основания образуют электролит, некоторые газы при определенных условиях также могут вести себя как электролит, например хлористый водород, при высокой температуре и низком давлении.
Химические реакции в электролизере
Объяснение окислительно-восстановительной реакции в электролизере
В электрохимических ячейках протекают окислительно-восстановительные (окислительно-восстановительные) реакции. Существует два типа электрохимических элементов: гальванические (вольтовы) элементы, в которых происходят самопроизвольные реакции, и электролитические элементы, в которых происходят несамопроизвольные реакции.
Оба типа ячеек имеют электроды, на которых происходят реакции окисления и восстановления. Окисление происходит на электроде, называемом анодом, а восстановление происходит на электроде, называемом катодом.
В электролизере анод положительный, а катод отрицательный. Это связано с тем, что анод притягивает анионы из раствора. С другой стороны, в гальваническом элементе анод заряжен отрицательно, поскольку самопроизвольное окисление на аноде является источником электронов или отрицательного заряда элемента. Катодом гальванического элемента является его положительный вывод.
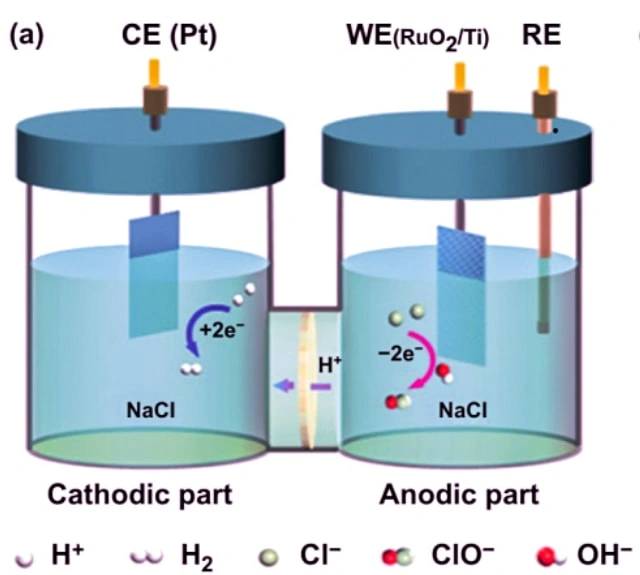
Пример электролиза хлорида натрия
Одним из примеров электролизера является электролиз хлорида натрия. При растворении хлорида натрия в воде и электролизе протекают следующие реакции:
На катоде: 2 H2O + 2 e- -> 2 OH- + H2.
На аноде: 2 Cl- -> Cl2 + 2 e-
Общая реакция: 2 NaCl + 2 H2O -> 2 Na + Cl2 + H2 + 2 OH-.
В этой электролитической ячейке два инертных электрода погружены в расплавленный хлорид натрия. Когда электрический ток проходит через цепь, катод обогащается электронами и приобретает отрицательный заряд. Положительно заряженные ионы натрия притягиваются к катоду, в результате чего образуется металлический натрий. В то же время атомы хлора притягиваются к положительно заряженному аноду, что приводит к образованию газообразного хлора. Общим результатом является производство металлического натрия, газообразного хлора и водного гидроксида натрия.
Применение электролизеров
Электролитические ячейки имеют различные применения:
- Производство газообразного кислорода и газообразного водорода из воды.
- Добыча алюминия из бокситов.
- Гальваника, которая предполагает формирование тонкого защитного слоя определенного металла на поверхности другого металла.
- Электрорафинирование цветных металлов.
- Электролитические процессы восстановления.
- Промышленное производство меди высокой чистоты, цинка высокой чистоты и алюминия высокой чистоты почти всегда осуществляется с помощью электролизеров.
![Применение электролизеров (цинк высокой чистоты, алюминий высокой чистоты, медь высокой чистоты)]()
Применение электролизеров (цинк высокой чистоты, алюминий высокой чистоты, медь высокой чистоты)
Электролизеры играют решающую роль в различных отраслях промышленности и процессах, обеспечивая производство важных химикатов и материалов.
Применение электролиза
Использование электролиза при электроосаждении для рафинирования или нанесения покрытия на металлы.
Электролиз широко используется в процессе электроосаждения для рафинирования или нанесения покрытий на металлы. Одним из практических применений электролиза в этом контексте является электроочистка. При электроочистке очищаемый предмет, например цинк или алюминий, делается катодом, и через раствор электролита пропускают сильный ток. На катоде вырабатывается каустическая сода и водород, которые эффективно удаляют жир и загрязнения с поверхности изделия. Этот процесс можно использовать для очистки или покрытия металлов, придания им чистого и блестящего вида, защиты от коррозии и замены изношенных материалов.
Производство каустической соды электролизом
Еще одним важным применением электролиза является крупномасштабное производство химических веществ, в том числе каустической соды (NaOH) и газообразного хлора. В этом процессе электролиз используется для расщепления хлорида натрия (NaCl) на его составные элементы: натрий (Na) и хлор (Cl2). Реакция на катоде включает восстановление ионов натрия (Na+) до металлического натрия (Na), а на аноде ионы хлорида (Cl-) окисляются с образованием газообразного хлора (Cl2). Общая реакция клетки: 2NaCl → 2Na + Cl2. С помощью этого электролитического процесса можно производить большие количества каустической соды и газообразного хлора для различных промышленных применений.
Электролиз при добыче металлов
Электролиз играет решающую роль в извлечении металлов из руд. Существует два основных метода извлечения металлов с помощью электролиза. При первом методе руду обрабатывают сильной кислотой для получения соли, а полученный раствор соли подвергают электролизу для выделения металла. При втором методе руда находится в расплавленном состоянии и подвергается непосредственному электролизу в печи.
Одним из примеров извлечения металлов с помощью электролиза является извлечение цинка. Цинковую руду обрабатывают серной кислотой с образованием раствора сульфата цинка, который затем подвергают электролизу. В электролизере используются алюминиевые катоды и свинцовые аноды. Цинк осаждается на катодах, а серная кислота регенерируется на анодах. Этот электролитический процесс позволяет получать цинк высокой чистоты.
Аналогичным образом электролиз используется и при извлечении алюминия из бокситов. Боксит, алюминиевая руда, растворяется в расплавленном криолите и подвергается электролизу. Ионы алюминия восстанавливаются на катоде, образуя металлический алюминий, а на аноде образуется газообразный кислород. Этот процесс позволяет производить алюминий высокой чистоты.

В целом электролиз находит практическое применение в различных отраслях промышленности для добычи, очистки и нанесения гальванических покрытий металлов, а также производства химических веществ, таких как каустическая сода. Используя возможности электролиза, предприятия могут достичь высококачественных результатов и удовлетворить потребности своих отраслей.
Преобразование химической энергии в электричество
Объяснение образования энергии в реакциях с участием веществ, выделяющих энергию.
В электрохимических ячейках химическая энергия преобразуется в электрическую посредством процесса, называемого электролизом. Электролиз — это окислительно-восстановительная реакция, происходящая в электрохимической ячейке, при которой на электродах разлагаются химические вещества. Продукты электролиза зависят от типа электрода и электролита, используемых в ячейке. Этот процесс является основой для различных приложений в электрохимии.
Область электрохимии предполагает производство электричества из энергии, выделяющейся во время спонтанных химических реакций, а также использование электрической энергии для запуска несамопроизвольных химических изменений. В основе этих процессов лежат окислительно-восстановительные реакции, которые включают перенос электронов между видами. Многие химические и биологические реакции являются окислительно-восстановительными реакциями и играют решающую роль в получении энергии для бытовых, транспортных или промышленных целей.
Энергия, вырабатываемая в этих реакциях, используется в широком спектре применений, включая сжигание топлива для переваривания пищи животными, промышленные процессы, фотосинтез, извлечение металлов из руд, производство важных химикатов, а также работу батарей и топливных элементов.
Пример свинцово-кислотной аккумуляторной батареи
Одним из примеров преобразования химической энергии в электричество является свинцово-кислотная аккумуляторная батарея. Этот тип аккумулятора обычно используется в качестве источника питания в транспортных средствах. Он состоит из нескольких электрохимических ячеек, соединенных вместе.

Свинцово-кислотная батарея работает как электролитический элемент, так и гальванический элемент. При разряде он действует как гальванический элемент, преобразуя химическую энергию в электрическую. В процессе разряда диоксид свинца, металлический свинец и серная кислота реагируют с образованием сульфата свинца и воды. Окисление свинца до сульфата свинца происходит на одном электроде, а восстановление диоксида свинца до сульфата свинца происходит на другом электроде. Электрический заряд переносится через электролит за счет миграции ионов водорода.
Такое разделение процессов окисления и восстановления создает движущую силу или напряжение, которое заставляет электричество течь через внешнюю цепь, соединяющую два электрода. В элементах и батареях использовалось множество других химических комбинаций, каждая из которых имела свои специфические реакции и характеристики.
Топливные элементы
Топливные элементы — это еще один тип электрохимического элемента, который преобразует химическую энергию топлива в электричество. Эти элементы работают за счет электрохимической реакции между водородным топливом и окислителем, обычно кислородом. В отличие от батарей, которые генерируют энергию из уже заполненных в них химических веществ, топливным элементам требуется непрерывный поток кислорода и подача топлива для выработки электроэнергии.
Топливные элементы используются НАСА в коммерческих целях для выработки энергии для космических капсул и спутников. Они предлагают преимущества с точки зрения термодинамической эффективности, поскольку позволяют избежать потерь в цикле Карно. Однако современная технология топливных элементов по-прежнему сталкивается с проблемами с точки зрения общей эффективности и надежности. Одним из ограничений является невозможность прямого использования углеводородов, что требует стадии переработки для преобразования обычного топлива в водород. Кроме того, катализ восстановления кислорода представляет собой сложный процесс.

Таким образом, преобразование химической энергии в электричество является фундаментальным процессом в электрохимии. Это происходит в результате окислительно-восстановительных реакций в электрохимических элементах, таких как свинцово-кислотные аккумуляторные батареи и топливные элементы. Эти технологии имеют различные применения: от привода транспортных средств до производства электроэнергии для освоения космоса.
Альтернативные ячейки для выработки электроэнергии
Понимание солнечных элементов и роли полупроводников и поглощения света
- Аморфный кремний (A-Si) является доминирующим тонкопленочным фотоэлектрическим материалом, светопоглощение которого примерно в 40 раз выше, чем у кристаллического кремния.
- Теллурид кадмия (CdTe) — еще один тонкопленочный материал с высоким светопоглощением. Он может поглощать 90% солнечного спектра с помощью пленки толщиной всего 1 мм.
- Диселенид меди и индия (CIGS) — это полупроводниковый материал, который достиг высокой эффективности в фотоэлектрических элементах, при этом коммерческие модули достигают эффективности 14% и более.

Объяснение топливных элементов и использования в них окислителей и восстановителей.
- Топливные элементы — это электрохимические элементы, которые реагируют с водородным топливом с кислородом или другим окислителем для преобразования химической энергии в электричество.
- Они отличаются от батарей, поскольку требуют постоянного источника топлива и кислорода для поддержания химической реакции.
- Топливные элементы могут производить электроэнергию непрерывно, пока подаются топливо и кислород.
- Они используются для основного и резервного питания в различных приложениях, включая коммерческие, промышленные, жилые здания и отдаленные районы.
- Топливные элементы также используются для питания транспортных средств на топливных элементах, таких как вилочные погрузчики, автомобили, автобусы, лодки, мотоциклы и подводные лодки.
- Ожидается, что к 2030 году мировой рынок топливных элементов вырастет на 19,9%.
Другие элементы для выработки электроэнергии
- Солнечные элементы генерируют электричество за счет поглощения света полупроводниками.
- Топливные элементы используют химическую энергию топлива для выработки электроэнергии.
- Перезаряжаемые элементы можно использовать несколько раз, перезаряжая их.
- Неперезаряжаемые элементы нельзя использовать повторно, их необходимо утилизировать.
- Свинцово-кислотные/свинцовые аккумуляторные батареи представляют собой вторичные элементы, используемые в качестве источника питания в транспортных средствах.
- Тонкопленочные элементы, такие как тонкопленочные солнечные элементы, тонкопленочные транзисторы и тонкопленочные батареи, обеспечивают повышенную эффективность, более быструю зарядку и более длительный срок службы по сравнению с обычными элементами.
Область альтернативных ячеек для производства электроэнергии постоянно развивается. Исследователи продолжают улучшать эффективность и свойства тонкопленочных материалов, а эксперты отрасли работают над снижением затрат и расширением производства.
Если вы заинтересованы в этом продукте, вы можете просмотреть веб-сайт нашей компании: https://kindle-tech.com/products/h-type-electrolytic-cell-h-type-triple , мы всегда настаиваем на принципе качества в первую очередь. В процессе производства мы строго контролируем каждый этап процесса, используя высококачественные материалы и передовые технологии производства, чтобы обеспечить стабильность и долговечность нашей продукции. чтобы гарантировать, что их работа соответствует самым высоким стандартам. Мы верим, что только предоставляя клиентам отличное качество, мы сможем завоевать их доверие и долгосрочное сотрудничество.
Связанные товары
- Электролитическая ячейка H-типа Тройная электрохимическая ячейка
- Электрохимическая ячейка для оценки покрытий
- Электрохимическая ячейка для спектроэлектролиза в тонком слое
- Многофункциональная электролитическая ячейка с водяной баней, однослойная, двухслойная
- Платиновая листовая электродная система для лабораторных и промышленных применений
Связанные статьи
- Невидимая переменная: Мастерство проверки электролитической ячейки
- Понимание электролизеров и их роли в очистке меди и гальванике
- Применение электролитических ячеек в очистке и гальванике
- Понимание кварцевых электролитических элементов: Применение, механизмы и преимущества
- Понимание электродов и электрохимических ячеек

















