Исторические открытия в области электрохимии
Эксперимент Гальвани с лягушкой
В 1791 году итальянский ученый Луиджи Гальвани провел новаторский эксперимент, который навсегда связал биологию и электрохимию. Во время препарирования лапки лягушки Гальвани заметил, что лапка дергается при соприкосновении с двумя разными металлами. Это, казалось бы, простое наблюдение привело к глубокому осознанию: биологические ткани могут генерировать электрические сигналы и реагировать на них.
Это открытие было не просто академическим любопытством; оно имело и практические последствия. Явление, наблюдаемое Гальвани, впоследствии получило название "гальваническое действие" и легло в основу разработки таких приборов, как гальванометр - инструмент, используемый для измерения малых электрических токов. Кроме того, процесс гальванизации - покрытие металлов для предотвращения коррозии - был назван в его честь, что подчеркивает долгосрочное влияние его работы.
Эксперимент Гальвани стал поворотным моментом в истории науки, преодолев разрыв между науками о жизни и физическими науками. Он продемонстрировал, что биологические системы могут быть поняты через призму электрохимических принципов, проложив путь для будущих достижений в обеих областях.
Изобретение Вольтой вольтовой сваи
В 1799 году итальянский физик Алессандро Вольта сделал революционное открытие, которое заложило основу для современных электрохимических систем. Он изобрел первый химический источник энергии, известный как вольтова куча, которая представляла собой стопку медных и цинковых дисков, разделенных увлажненной тканью или картоном, смоченным в рассоле. Это простое, но гениальное устройство могло генерировать постоянный электрический ток, что ознаменовало начало практического производства электроэнергии.
Значение изобретения Вольты было быстро осознано, и оно послужило толчком к дальнейшим исследованиям потенциального применения этого новоизобретенного источника энергии. Всего год спустя, в 1800 году, Уильям Николсон и Энтони Карлайл использовали вольтову кучу, чтобы провести первый успешный электролиз воды. В ходе эксперимента они наблюдали выделение газов, в частности водорода и кислорода, что подтверждало разложение молекул воды на составляющие элементы под действием электрического тока.
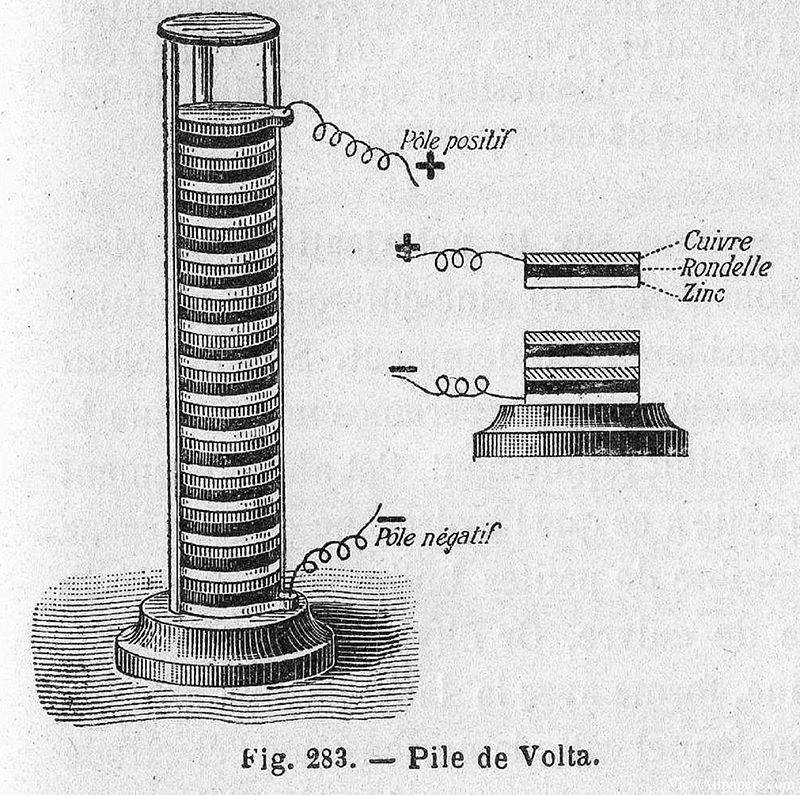
Это открытие не только подтвердило концепцию электролиза, но и продемонстрировало практическую пользу кучи Вольта в научных экспериментах. Способность разлагать соединения на составные части с помощью электричества открыла новые возможности для исследований в области химии и физики, проложив путь для будущих достижений в области электрохимической теории и приложений.
Успехи электролиза
В 1803 году Хамфри Дэви добился революционного успеха в области электрохимии, успешно выделив металлы калий и натрий с помощью процесса электролиза. Это грандиозное открытие не только продемонстрировало возможности электрохимических методов, но и открыло путь к получению активных мономеров металлов, которые необходимы в различных промышленных приложениях.
В экспериментах Дэви использовал вольтову сваю - первый химический источник энергии, изобретенный Алессандро Вольта. Пропуская электрический ток через расплавленные соли, Дэви смог разложить эти соединения и получить чистые металлы. Эта техника ознаменовала собой значительный прогресс в извлечении реактивных металлов, которые ранее было трудно выделить с помощью традиционных химических методов.
Последствия работы Дэви вышли за пределы лаборатории. Его успех в электролизе заложил основу для будущих исследований в области электрохимических процессов, что привело к разработке более эффективных методов извлечения и очистки металлов. Это открытие также подчеркнуло потенциал электрохимических методов в различных отраслях промышленности, от металлургии до химического производства.
Кроме того, открытия Дэви способствовали более глубокому пониманию принципов электрохимии, заложив основу для последующих теоретических разработок, таких как закон электролиза Фарадея и уравнение Нернста. Эти теоретические основы, в свою очередь, позволили проводить более точные количественные исследования электрохимических явлений, что способствовало дальнейшему прогрессу в этой области.
Таким образом, успешный электролиз калия и натрия, проведенный Дэви в 1803 году, стал поворотным моментом в истории электрохимии, продемонстрировав практическое применение электрохимических методов и заложив основу для будущих инноваций в этой области.
Теоретические основы электрохимии
Закон Фарадея об электролизе
В 1834 году Майкл Фарадей, новатор в области физики и химии, сформулировал закон электролиза, ставший краеугольным камнем в области электрохимии. Этот закон обеспечил количественную основу для понимания и анализа электрохимических явлений, значительно продвинув теоретические основы этой дисциплины. Работа Фарадея сыграла важную роль в преодолении разрыва между эмпирическими наблюдениями и теоретическими моделями, заложив основу для будущих открытий и приложений в электрохимии.
Закон электролиза Фарадея состоит из двух основных принципов:
- Первый закон: Масса вещества, осаждающегося или высвобождающегося на электроде при электролизе, прямо пропорциональна количеству электричества, пропущенного через электролит.
- Второй закон: Масса вещества, осажденного или высвобожденного на электроде при электролизе, прямо пропорциональна химическому эквиваленту веса вещества.
Эти законы позволили ученым точно измерить количество вещества, преобразованного в ходе электрохимической реакции, что способствовало разработке стандартизированных процедур и методов в электрохимии. Количественно определяя связь между электрическим током, временем и происходящими химическими изменениями, законы Фарадея обеспечили надежный метод изучения и прогнозирования электрохимических процессов.
Влияние работы Фарадея вышло за рамки простого количественного анализа. Его законы способствовали более глубокому пониманию механизмов, лежащих в основе электролиза, что, в свою очередь, привело к усовершенствованию различных практических приложений. Эти приложения варьировались от промышленных процессов, таких как рафинирование металлов и нанесение гальванических покрытий, до разработки батарей и топливных элементов, которые являются неотъемлемой частью современных энергетических систем.
Кроме того, вклад Фарадея заложил основу для последующих теоретических разработок в области электрохимии. Его законы стали основой для работы более поздних ученых, таких как Вальтер Нернст, который вывел уравнение Нернста, и Юлиус Тафель, сформулировавший уравнение Тафеля. Эти открытия позволили углубить понимание электродных потенциалов, кинетики реакций и поведения ионов в растворе, что является важнейшими аспектами современных электрохимических исследований.
Таким образом, закон электролиза Фарадея не только произвел революцию в количественном изучении электрохимических явлений, но и заложил прочный теоретический фундамент для бурно развивающейся области электрохимии. Его работа продолжает оказывать влияние на современные исследования и приложения и вдохновлять их, подчеркивая непреходящее значение его вклада в науку.
Уравнение Нернста
В 1889 году немецкий химик Вальтер Нернст внес новаторский вклад в развитие электрохимии, выведя математическое соотношение, связывающее потенциал электрода с концентрацией веществ, участвующих в электрохимической реакции. Это соотношение, известное сегодня как уравнение Нернста, стало краеугольным камнем в изучении электрохимических систем.
Уравнение Нернста позволяет количественно предсказать потенциал электрохимической ячейки в нестандартных условиях, что очень важно для понимания и управления электрохимическими процессами. Оно выражается как:
[ E = E^\circ - \frac{RT}{nF} \ln Q ]
где:
- ( E ) - электродный потенциал.
- ( E^\circ ) - стандартный электродный потенциал.
- ( R ) - универсальная газовая постоянная.
- ( T ) - температура в Кельвинах.
- ( n ) - число молей электронов, переданных в ходе реакции.
- ( F ) - постоянная Фарадея.
- ( Q ) - коэффициент реакции.
Уравнение демонстрирует, как изменение концентрации может повлиять на потенциал электрода, что крайне важно для различных применений - от разработки аккумуляторов до промышленных процессов электролиза. Позволяя ученым предсказывать электродные потенциалы и манипулировать ими, уравнение Нернста значительно расширило наши возможности по проектированию и оптимизации электрохимических систем.
Это открытие стало не только теоретическим, но и практическим триумфом, поскольку дало ученым и инженерам инструмент для лучшего понимания и управления поведением электрохимических ячеек в различных условиях. Уравнение Нернста остается неотъемлемой частью электрохимической теории и практики, подчеркивая глубокое влияние работы Нернста на эту область.
Уравнение Тафеля
В 1905 году Юлиус Тафель вывел новаторскую эмпирическую формулу, которая устанавливала прямую зависимость между плотностью тока и водородным перепотенциалом. Это уравнение, известное как уравнение Тафеля, сыграло решающую роль в развитии нашего понимания электрохимической кинетики. Работа Тафеля сыграла важную роль в выяснении механизмов, лежащих в основе скорости электрохимических реакций, особенно тех, которые связаны с выделением водорода.
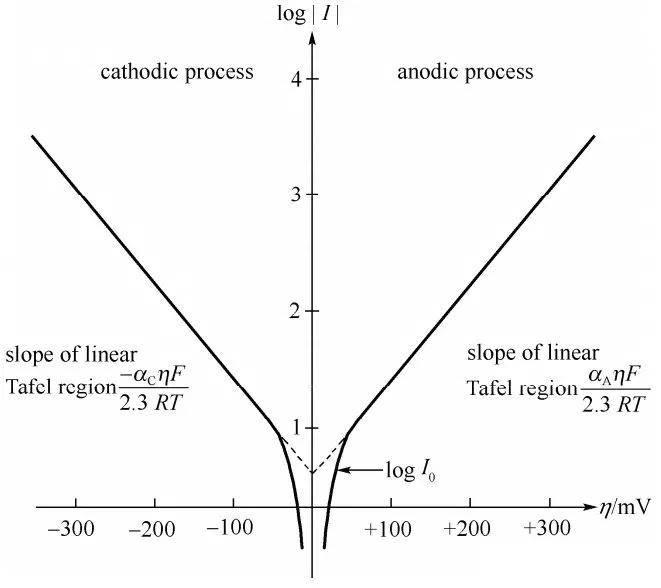
Уравнение Тафеля обычно выражается как:
$$ \eta = a + b \log(i) $$
где:
- (\eta) - оверпотенциал,
- (i) - плотность тока,
- (a) и (b) - константы, характерные для материала электрода и условий реакции.
Значение уравнения Тафеля заключается в его способности количественно описывать скорость электрохимических процессов, что имеет решающее значение для оптимизации электродных материалов и условий реакции. Этот эмпирический закон был широко проверен и применен в различных электрохимических системах, от фундаментальных исследований до промышленных применений.
| Параметр | Описание |
|---|---|
| (\eta) | Надпотенциал, дополнительное напряжение, необходимое для выхода за пределы равновесного потенциала |
| (i) | Плотность тока, ток на единицу площади поверхности электрода |
| (a) | Постоянная, связанная с плотностью обменного тока и фактором симметрии |
| (b) | Наклон Тафеля, связанный с коэффициентом переноса заряда. |
Пионерская работа Тафеля заложила основу для последующих исследований в области электрохимической кинетики, повлияв на развитие более сложных теорий и методов. Его уравнение остается краеугольным камнем в этой области, подчеркивая сложное взаимодействие между электрическими и химическими процессами в электрохимии.
Электрохимическая кинетика и техника
С 1940 года в области межфазной электрохимии произошли значительные подвижки, особенно в понимании структуры двойного слоя и кинетики осаждения водорода. Эти достижения заложили основу для более сложных теорий и методов электрохимической кинетики. Одним из наиболее заметных вкладов в этот период стало создание микроскопической теории переноса электронов Маркуса. Эта теория обеспечила детальную основу для понимания того, как электроны перемещаются через границы раздела фаз, что имеет решающее значение для многих электрохимических процессов.
Достижения в области электрохимической кинетики не ограничивались теоретическими построениями. Развивались и экспериментальные методы, позволяющие исследователям с большей точностью изучать поведение электронов и ионов на границах раздела фаз. Например, разработка новых спектроскопических методов позволила наблюдать за химическими реакциями, протекающими на поверхности электродов, в режиме реального времени. Эти методы сыграли важную роль в проверке и уточнении теоретических моделей, таких как теория Маркуса, предоставив эмпирические данные, которые можно напрямую сравнить с теоретическими предсказаниями.
Более того, взаимодействие теоретических и экспериментальных достижений привело к разработке более эффективных электрохимических систем. Например, понимание кинетики осаждения водорода было использовано при разработке более совершенных топливных элементов и батарей, которые необходимы для современных технологий хранения и преобразования энергии. Улучшенная кинетика позволяет повысить эффективность и увеличить срок службы этих систем.
В целом, период с 1940 года ознаменовал собой эпоху преобразований в электрохимической кинетике и технике. Синергия между теоретическими знаниями и экспериментальными возможностями не только углубила наше понимание фундаментальных процессов, но и проложила путь к практическому применению в энергетике и материаловедении.
Электрохимические методы in situ
С момента своего появления в 1970-х годах электрохимические методы in situ произвели революцию в изучении электрохимических механизмов. Эти методы позволяют исследователям наблюдать и анализировать электрохимические процессы непосредственно в рабочих средах, обеспечивая беспрецедентное понимание динамики реакций на границе раздела электрод-электролит.
Одним из наиболее значительных достижений в этой области является интеграция электрохимической рентгеновской абсорбционной спектроскопии (XAS) in situ. Этот метод позволяет в режиме реального времени отслеживать изменения в электронной структуре и состояниях окисления материалов в ходе электрохимических реакций. Сочетая XAS с электрохимическими методами, ученые могут соотнести структурные преобразования с электрохимическими характеристиками, тем самым углубляя наше понимание каталитических процессов и электродных материалов.
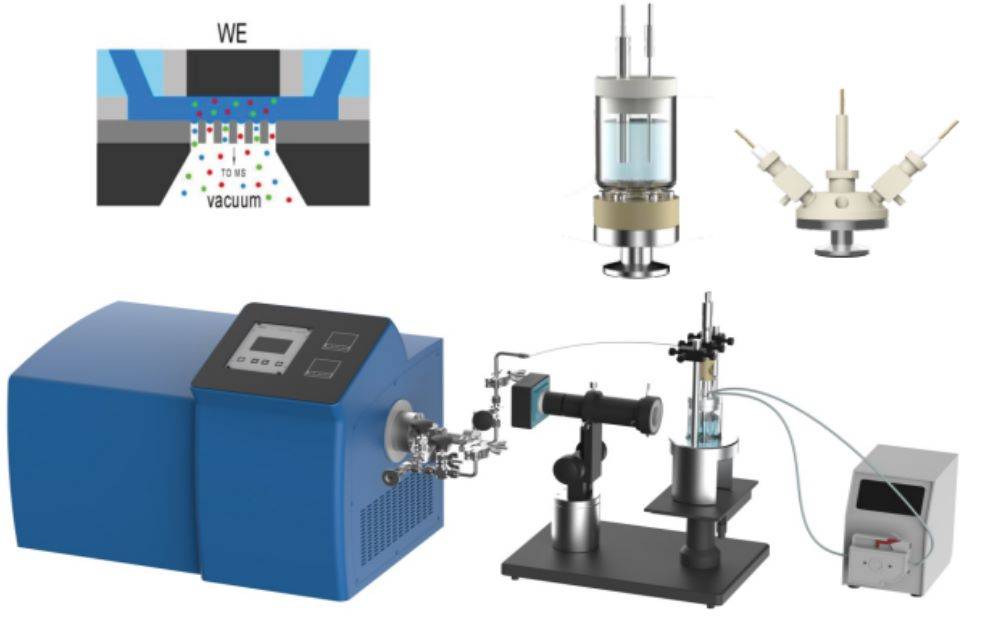
Помимо XAS, широкое распространение получили и другие методы in situ, такие как сканирующая электрохимическая микроскопия (SECM) и рамановская спектроскопия in situ. SECM позволяет получить пространственное разрешение электрохимических процессов в микрометровом масштабе, а рамановская спектроскопия in situ дает подробную колебательную информацию о видах, участвующих в реакциях.
Универсальность и точность электрохимических методов in situ не только способствуют фундаментальным исследованиям, но и ускоряют разработку практических приложений. Например, эти методы играют важную роль в оптимизации работы батарей, топливных элементов и электрокатализаторов. Предоставляя в режиме реального времени данные о промежуточных продуктах реакции и модификации поверхности, методы in situ помогают разрабатывать более эффективные и долговечные электрохимические устройства.
Более того, постоянное развитие этих методов расширяет их применимость. Достижения в области аппаратуры и методов анализа данных позволяют повысить разрешение, ускорить получение данных и более точно интерпретировать результаты. Этот прогресс прокладывает путь к следующему поколению электрохимических исследований, где методы in situ будут играть ключевую роль в раскрытии сложностей электрохимических систем.
Современные направления в электрохимии
Микроскопические электрохимические механизмы
Изучение электрохимических процессов на атомном и молекулярном уровнях является центральным направлением современных исследований. В этой области в основном используются in situ и не in situ для изучения сложных механизмов, управляющих этими процессами. Эти методы позволяют исследователям наблюдать и анализировать электрохимические реакции в процессе их протекания, обеспечивая беспрецедентное понимание динамики происходящих процессов.
Одним из ключевых достижений в этой области является использование электрохимической рентгеновской абсорбционной спектроскопии in situ (XAS) . Этот метод позволяет в режиме реального времени отслеживать изменения в электронной структуре и состояниях окисления материалов в ходе электрохимических реакций. Например, XAS может показать, как изменяется поверхность катализатора во время катализа конкретной реакции, что дает подсказку для оптимизации катализатора для повышения его эффективности.
Кроме того, сканирующая туннельная микроскопия (СТМ) и атомно-силовая микроскопия (АСМ) помогают визуализировать морфологию поверхности и электронные свойства электродов на атомном уровне. Эти методы имеют решающее значение для понимания того, как поверхностные дефекты, адсорбаты и другие микроскопические особенности влияют на электрохимическое поведение материалов.
Чтобы построить всеобъемлющий и рациональный механизм реакции, исследователи часто объединяют эти микроскопические наблюдения с теоретическими моделями. Например, теория функционала плотности (DFT) позволяет предсказать энергетические ландшафты потенциальных путей реакции, а молекулярная динамика (МД) моделирует зависящее от времени поведение ионов и молекул в электролите.
Интеграция экспериментальных и теоретических подходов привела к значительным прорывам в этой области. Например, рациональный дизайн электрокатализаторов для расщепления воды и восстановления CO₂ был разработан на основе результатов этих совместных усилий. Такие достижения не только улучшают наше фундаментальное понимание электрохимических процессов, но и прокладывают путь к разработке более эффективных и устойчивых энергетических технологий.
В целом, использование передовых методов in situ и не in situ в сочетании с теоретическим моделированием произвело революцию в изучении электрохимических механизмов на микроскопическом уровне. Этот междисциплинарный подход продолжает стимулировать инновации как в академических исследованиях, так и в промышленных приложениях.
Достижения в области электрохимических испытаний
Традиционные электрохимические методы претерпевают значительные изменения, чтобы соответствовать современным требованиям. Эти изменения обусловлены необходимостью повышения чувствительности мониторинга, адаптации к экстремальным условиям окружающей среды и интеграции сложных математических методов. Эволюция методов электрохимического тестирования - это не просто постепенное улучшение, а смена парадигмы, которая преодолевает разрыв между теоретическим пониманием и практическим применением.
Одной из ключевых областей развития является интеграция передовых математических моделей. Эти модели позволяют более точно предсказывать и интерпретировать электрохимические явления, особенно в сложных системах, где традиционные методы оказываются неэффективными. Например, включение алгоритмов машинного обучения позволило проводить анализ и оптимизацию электрохимических процессов в режиме реального времени, значительно сократив время и ресурсы, необходимые для проведения экспериментов.

Кроме того, адаптация этих методов к экстремальным условиям открыла новые возможности для исследований и применения. Будь то высокие температуры промышленных процессов или низкие температуры космических исследований, современные электрохимические методы настраиваются на надежную и эффективную работу. Такая адаптация крайне важна для различных отраслей промышленности - от производства энергии до материаловедения, где условия могут сильно меняться.
Помимо математических достижений, аппаратные компоненты электрохимических испытаний также претерпели значительные улучшения. Высокоточные датчики и автоматизированные системы стали обычным явлением, позволяющим осуществлять непрерывный мониторинг и сбор данных. Эти системы не только более точны, но и более удобны в использовании, что делает передовые электрохимические испытания доступными для более широкого круга исследователей и промышленников.
Синергия между этими достижениями в области математического моделирования, адаптации к окружающей среде и совершенствования аппаратного обеспечения привела к новой эре в электрохимических испытаниях. Эта эра характеризуется большей точностью, эффективностью и применимостью, прокладывая путь к прорыву как в фундаментальных исследованиях, так и в практическом применении.
Междисциплинарные применения
Универсальность электрохимии проявляется в ее широком применении в различных научных и промышленных областях. Одной из наиболее значимых областей применения является электросинтез который использует электрохимические процессы для синтеза сложных органических и неорганических соединений. Этот метод особенно полезен в производстве фармацевтических препаратов, агрохимикатов и специальных химикатов, обеспечивая точный контроль над условиями реакции и минимизируя количество отходов.
Процессы электролиза являются еще одним краеугольным камнем современной электрохимии, играя решающую роль в производстве таких важных промышленных химикатов, как хлор и гидроксид натрия в хлорно-щелочной промышленности. Кроме того, электролиз играет важную роль в добыче таких металлов, как алюминий, и в производстве водорода путем электролиза воды, что имеет ключевое значение для устойчивых энергетических решений.
Защита от коррозии это важнейшая область применения, где электрохимические принципы используются для защиты металлов от разрушения. Такие методы, как гальваническое покрытие, защита жертвенным анодом и анодная защита, широко используются для продления срока службы металлических конструкций в различных условиях, от морских до промышленных объектов.
Электрокатализ представляет собой передовую область, в которой электрохимия пересекается с катализом для повышения эффективности химических реакций. Это особенно важно при разработке топливных элементов, которые преобразуют химическую энергию непосредственно в электрическую с высокой эффективностью и минимальным воздействием на окружающую среду.
В сфере новых источников энергии Электрохимия находится в авангарде исследований передовых технологий производства аккумуляторов, включая литий-ионные и твердотельные батареи. Эти технологии необходимы для перехода к системам возобновляемых источников энергии, обеспечивая более высокую плотность энергии и более длительный срок службы по сравнению с традиционными батареями.
Фотоэлектрохимия объединяет фотохимию и электрохимию, используя световую энергию для запуска электрохимических реакций. Эта область имеет решающее значение для разработки солнечных батарей и фотоэлектрохимического расщепления воды, которые могут преобразовывать солнечный свет непосредственно в водород, чистое и богатое топливо.
И последнее, биоэлектрохимия это развивающаяся дисциплина, которая применяет электрохимические принципы к биологическим системам. Это включает в себя разработку биосенсоров для медицинской диагностики и биоэлектрокатализ для биоремедиации и производства биоэнергии. Эти приложения подчеркивают глубокое влияние электрохимии как на здоровье человека, так и на экологическую устойчивость.
Практические применения электрохимии
Электролиз и электросинтез
Электролиз и электросинтез играют ключевую роль в превращении сырья в ценные продукты, стимулируя ряд промышленных процессов. Сайт хлорно-щелочная промышленность является краеугольным камнем, использующим электролиз для производства хлора и гидроксида натрия, необходимых для различных химических процессов и производственных отраслей. Этот процесс не только обеспечивает стабильное снабжение этими химическими веществами, но и подчеркивает эффективность и масштабируемость электрохимических методов.
В области электролиз алюминия незаменимым остается процесс Холла-Герольта. Этот метод, включающий электролитическое восстановление глинозема, растворенного в расплавленном криолите, имеет решающее значение для мировой индустрии производства алюминия. Постоянное совершенствование и оптимизация этого процесса позволили значительно снизить энергопотребление и воздействие на окружающую среду, что делает его образцом устойчивой промышленной практики.

Электролиз воды привлекает значительное внимание, особенно в контексте хранения возобновляемой энергии и производства водорода. Расщепляя воду на водород и кислород с помощью электрического тока, этот процесс предлагает чистое и масштабируемое решение для получения водородного топлива, которое можно хранить и использовать для питания различных приложений, от транспорта до промышленных процессов.
Электросинтез расширяет сферу применения электрохимических технологий, позволяя синтезировать сложные органические молекулы и фармацевтические препараты. Эта технология позволяет точно контролировать условия реакции, что приводит к повышению выхода и чистоты продуктов. Универсальность электросинтеза подтверждается его использованием в производстве тонких химических веществ, агрохимикатов и специальных материалов, что усиливает его значение в современном химическом производстве.
Эти области применения в совокупности подчеркивают преобразующий потенциал электролиза и электросинтеза, стимулируя инновации во многих отраслях промышленности и способствуя достижению целей устойчивого развития.
Коррозия и защита металлов
Коррозия металлов является серьезной проблемой в различных отраслях промышленности, приводящей к значительным экономическим потерям и угрозе безопасности. Для смягчения этих последствий было разработано и внедрено несколько передовых методов. Среди них, гальваническое покрытие выделяется как универсальная техника, которая не только повышает эстетическую привлекательность металлов, но и значительно улучшает их устойчивость к коррозии. Нанося на поверхность основного металла тонкий слой более коррозионностойкого металла, гальваника служит защитным барьером от воздействия окружающей среды.
Другим эффективным методом является жертвенная анодная защита который заключается в прикреплении более реактивного металла к конструкции, нуждающейся в защите. Этот жертвенный металл, часто изготовленный из магния или цинка, подвергается преимущественной коррозии, тем самым защищая основной металл от коррозии. Этот метод широко используется в морской среде, где скорость коррозии особенно высока.
Анодная защита еще один сложный подход, который заключается в поляризации металла до потенциала, при котором он становится пассивным, что значительно снижает скорость его коррозии. Этот метод особенно эффективен для металлов, способных образовывать устойчивый оксидный слой, таких как нержавеющая сталь. Контролируя потенциал, анодная защита может продлить срок службы важнейших объектов инфраструктуры в таких отраслях, как химическая и нефтеперерабатывающая.
Эти методы, наряду с другими, такими как катодная защита и технологии нанесения покрытий в совокупности образуют надежный арсенал для борьбы с коррозией металлов, обеспечивая долговечность и надежность металлических конструкций в различных областях применения.
Биоэлектрохимия
Биоэлектрохимия представляет собой увлекательное пересечение биологии и электрохимии, с широким спектром применения - от медицинской диагностики до мониторинга окружающей среды. Одним из наиболее заметных применений является разработка биосенсоров которые используют биологические молекулы для обнаружения и количественного определения специфических веществ. Эти датчики играют ключевую роль в медицинской диагностике, позволяя быстро и точно определять биомаркеры, гормоны и патогены. Например, биосенсоры глюкозы широко используются в лечении диабета, обеспечивая мониторинг уровня глюкозы в крови в режиме реального времени.
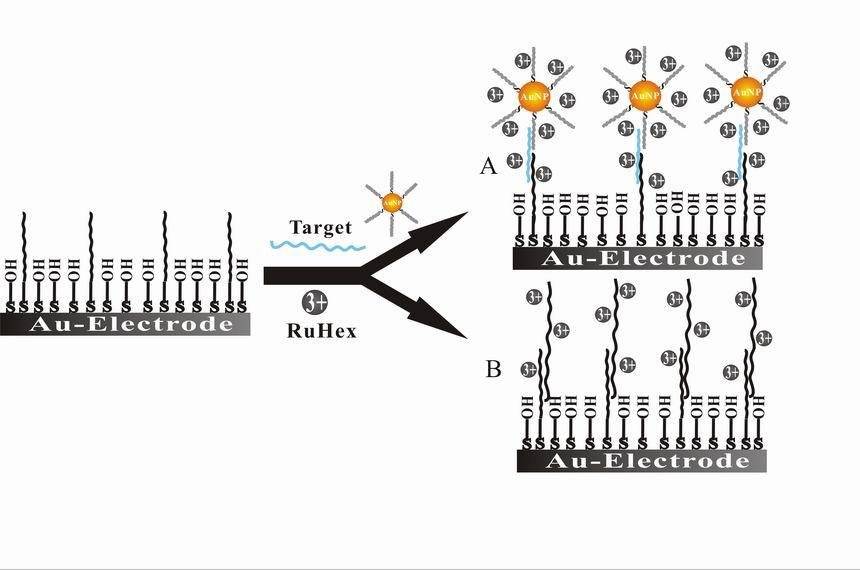
В дополнение к биосенсорам, биоэлектрокатализ еще одна важнейшая область биоэлектрохимии. Эта область фокусируется на использовании ферментов или микроорганизмов в качестве катализаторов в электрохимических реакциях, повышая эффективность и специфичность этих процессов. Биоэлектрокатализ имеет большое значение для возобновляемой энергетики, переработки отходов и промышленных процессов. Например, микробные топливные элементы используют биоэлектрокатализ для преобразования органических отходов непосредственно в электричество, предлагая устойчивое решение для производства энергии и утилизации отходов.
| Применение | Описание | Пример |
|---|---|---|
| Биосенсоры | Используют биологические молекулы для обнаружения и количественного определения. | Биосенсоры глюкозы для лечения диабета |
| Биоэлектрокатализ | Использование ферментов или микроорганизмов в качестве катализаторов в электрохимических реакциях | Микробные топливные элементы для производства энергии из органических отходов |
Синергия биологических и электрохимических принципов в биоэлектрохимии продолжает стимулировать инновации, обещая новые инструменты и методы как для научных исследований, так и для практического применения.
Химические источники питания
Химические источники питания включают в себя широкий спектр технологий, каждая из которых обладает уникальными характеристиками и областью применения. К основным категориям относятся первичные батареи, вторичные батареи, литий-ионные батареи и топливные элементы. Первичные батареи, такие как щелочные и цинково-углеродные, предназначены для одноразового использования и часто встречаются в таких повседневных устройствах, как пульты дистанционного управления и фонари. Вторичные, или перезаряжаемые, батареи включают свинцово-кислотные и никель-металлгидридные, которые можно заряжать многократно, что делает их идеальными для приложений, требующих стабильного питания в течение длительного времени.
Литий-ионные батареи произвели революцию в портативной электронике и электромобилях благодаря высокой плотности энергии, длительному сроку службы и низкой скорости саморазряда. Эти батареи состоят из литиевых соединений в качестве электродов и неводного электролита, что обеспечивает баланс между стоимостью, производительностью и воздействием на окружающую среду.
Топливные элементы, с другой стороны, представляют собой значительное достижение в технологии устойчивой энергетики. В отличие от батарей, которые накапливают энергию химическим путем, топливные элементы вырабатывают электричество в результате электрохимической реакции топлива, обычно водорода, с окислителем, обычно кислородом. Этот процесс обеспечивает высокую эффективность, низкий уровень загрязнения окружающей среды и возможность регулировать выработку энергии в зависимости от спроса. Топливные элементы особенно перспективны для таких применений, как электромобили, системы резервного питания и даже освоение космоса, где надежная и чистая энергия имеет первостепенное значение.
| Тип батареи | Основные области применения | Ключевые преимущества |
|---|---|---|
| Первичные батареи | Устройства одноразового использования (пульты дистанционного управления, фонарики) | Экономически эффективны, широко доступны |
| Вторичные батареи | Перезаряжаемые устройства (телефоны, ноутбуки) | Многоразовые, с длительным сроком службы |
| Литий-ионные батареи | Портативная электроника, электромобили | Высокая плотность энергии, низкий саморазряд |
| Топливные элементы | Электромобили, резервное питание, космос | Высокая эффективность, низкий уровень загрязнения, масштабируемость |
Связанные товары
- Лабораторная электрохимическая рабочая станция Потенциостат для лабораторного использования
- Золотой дисковый электрод
- Электрод из золотого листа для электрохимии
- Крепление для электродов для электрохимических экспериментов
- Электролитическая ячейка H-типа Тройная электрохимическая ячейка
Связанные статьи
- Руководство по портативным анализаторам сплавов: Особенности, применение и преимущества
- Исследование многофункциональной водяной бани для электролитических ячеек: Применение и преимущества
- Революционный контроль качества: Окончательное руководство по ручным анализаторам литиевых батарей
- Архитектура определенности: освоение контроля в многофункциональных электролитических ячейках
- Понимание насыщенных каломельных эталонных электродов: Состав, применение и соображения













